题目内容
5.元素化合价发生改变的反应都是氧化还原反应.例如:2$\stackrel{0}{Fe}$+3$\stackrel{0}{C{l}_{2}}$$\frac{\underline{\;点燃\;}}{\;}$2$\stackrel{+3}{Fe}$$\stackrel{-1}{Cl}$3,反应前后,Fe和Cl元素的化合价发生了改变,该反应是氧化还原反应.下列反应不属于氧化还原反应的是( )| A. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | B. | 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 | ||
| C. | Zn+H2SO4=ZnSO4+H2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
分析 根据题干提供的信息进行分析,元素化合价改变则属于氧化还原反应,反应中有单质参加或生成的一定有化合价的变化据此解答.
解答 解:A、4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,反应中有单质参加故有化合价变化,属于氧化还原反应;
B、2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,属于复分解反应,没有单质参加化学反应前后各元素的化合价均不变,不属于氧化还原反应;
C、Zn+H2SO4=ZnSO4+H2↑,反应中有单质参加故有化合价变化,属于氧化还原反应;
D、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,反应中由化合物分解为单质故有化合价变化,属于氧化还原反应;
故选B
点评 本题考查了氧化还原反应的判断,完成此题,可以抓住反应前后元素的化合价改变进行.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
4.下列属于物质化学性质的是( )
| A. | 吸附性 | B. | 密度 | C. | 气味 | D. | 可燃性 |
16.某校学生在探究金属的化学性质时,实验情况如下:
[提出问题]从上述实验现象中,你发现了什么问题?铝和稀硫酸反应为什么没有气泡产生[猜想]针对你发现的问题,分析其原因,大胆提出你的一个猜想:
[设计方案]根据你的猜想,任选下列实验用品,进行实验设计.
实验用品:10%的稀硫酸、30%的稀硫酸、相同大小的铝片(若干)、氯化钠试管、试管夹、酒精灯、镊子、药匙、砂纸
[提出问题]从上述实验现象中,你发现了什么问题?铝和稀硫酸反应为什么没有气泡产生[猜想]针对你发现的问题,分析其原因,大胆提出你的一个猜想:
[设计方案]根据你的猜想,任选下列实验用品,进行实验设计.
实验用品:10%的稀硫酸、30%的稀硫酸、相同大小的铝片(若干)、氯化钠试管、试管夹、酒精灯、镊子、药匙、砂纸
| 实验操作 | 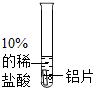 |  |
| 实验现象 | 铝片表面有气泡产生 | 没有明显现象 |
| 操作步骤(用图示说明或文字叙述均可) | 可能观察到的实验现象 | 相应的结论 |
| 用砂纸把铝片打磨后放入10%的稀硫酸中 | 铝片表面有气泡产生 | 我的猜想正确 |
14.下列关于实验现象的描述中,错误的是( )
| A. | 将红热的细铁丝放在氧气中,剧烈燃烧,火星四射,生成黑色固体 | |
| B. | 在空气中点燃镁条,发出耀眼的白光;生成白色固体 | |
| C. | 向盛有块状石灰石试管中倒入稀硫酸,有大量气泡冒出迅 | |
| D. | 向盛有锌粒的试管中滴加稀硫酸,有气泡冒出 |
15.用CO2和NH3合成尿素[CO(NH2)2]是固定和利用CO2的成功范例,其反应的化学方程式为:CO2+2NH3=CO(NH2)2+H2O.下列说法正确的是( )
| A. | 尿素中有2个氮原子 | |
| B. | 参加反应的CO2与NH3的质量比是44:17 | |
| C. | 尿素的相对分子质量是60g | |
| D. | 该反应是充分利用CO2的一种有效途径 |

 某化学兴趣小组用盛有AgNO3、Cu(NO3)2的混合溶液进行了如图实验
某化学兴趣小组用盛有AgNO3、Cu(NO3)2的混合溶液进行了如图实验