题目内容
已知:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量;
(2)被氧化的HCl物质的量;
(3)原浓盐酸的物质的量浓度.
解:4.48L氯气的物质的量为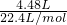 ═0.2mol
═0.2mol
设反应耗用MnO2的质量为x,参加反应的HCl物质的量为y
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87 4 1
x y 0.2mol

x=17.4g y=0.8mol
(2)被氧化的HCl物质的量为 =0.4mol
=0.4mol
(3)原浓盐酸的物质的量浓度为 =9 mol/L
=9 mol/L
答:(1)反应耗用MnO2的质量为17.4g
(2)被氧化的HCl物质的量0.4mol
(3)原浓盐酸的物质的量浓度9 mol/L
分析:根据化学方程式和各物质的量的关系可求出耗用MnO2的质量和参加反应的氯化氢的物质的量
点评:本题主要考查有关化学方程式的计算和物质的量的计算,难度较小
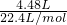 ═0.2mol
═0.2mol设反应耗用MnO2的质量为x,参加反应的HCl物质的量为y
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O87 4 1
x y 0.2mol

x=17.4g y=0.8mol
(2)被氧化的HCl物质的量为
 =0.4mol
=0.4mol(3)原浓盐酸的物质的量浓度为
 =9 mol/L
=9 mol/L答:(1)反应耗用MnO2的质量为17.4g
(2)被氧化的HCl物质的量0.4mol
(3)原浓盐酸的物质的量浓度9 mol/L
分析:根据化学方程式和各物质的量的关系可求出耗用MnO2的质量和参加反应的氯化氢的物质的量
点评:本题主要考查有关化学方程式的计算和物质的量的计算,难度较小

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目

