题目内容
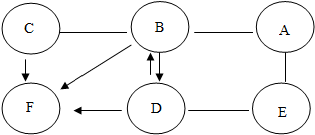
8.向硝酸银、硝酸铜的混合溶液中加入一些铁粉,等完全反应后再过滤.下列情况不可能出现的是( )| A. | 滤纸上若有Ag,滤液中可能有有Fe2+、Cu2+、Ag+ | |
| B. | 滤纸上若有Ag、Cu,滤液中不可能有Ag+ | |
| C. | 滤纸上若有Ag、Cu、Fe,滤液中一定只有Fe2+ | |
| D. | 滤纸上若有Ag、Cu、Fe,滤液中可能有Cu2+、Ag+ |
分析 根据在金属活动性顺序中,铁>铜>银,位置在前的金属能将位于其后的金属从其盐溶液中置换出来进行分析.
解答 解:AgNO3、Cu(NO3)2的混合溶液中加入一些铁粉,铁>铜>银,铁与硝酸银反应生成硝酸亚铁和银,铁与硝酸铜反应生成硝酸亚铁和铜,生成的铜与硝酸银能反应生成硝酸铜和银.
A、当铁粉量不足时,只与部分硝酸银反应,生成银,仍有硝酸银剩余,故A正确;
B、铜会置换出溶液中的银,所以滤纸上若有Ag、Cu,滤液中不可能有Ag+,故B正确;
C、当铁粉过量时,与混合液中的硝酸银和硝酸铜完全反应,生成银和铜,铁有剩余,故C正确;
D、铜会置换出溶液中的银,所以滤纸上若有Ag、Cu、Fe,滤液中不可能有Ag+,故D错误.
故选:D.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.空气成分中,可充入灯泡中制成霓虹灯的是( )
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 稀有气体 |
17. 一定质量的镁条在氧气中完全燃烧后生成氧化镁.固体质量随时间的变化关系如图所示.下列说法不正确的是( )
一定质量的镁条在氧气中完全燃烧后生成氧化镁.固体质量随时间的变化关系如图所示.下列说法不正确的是( )
 一定质量的镁条在氧气中完全燃烧后生成氧化镁.固体质量随时间的变化关系如图所示.下列说法不正确的是( )
一定质量的镁条在氧气中完全燃烧后生成氧化镁.固体质量随时间的变化关系如图所示.下列说法不正确的是( )| A. | 生成氧化镁的质量为m2g | B. | 参加反应镁的质量为m1g | ||
| C. | 参加反应氧气的质量为:(m2-m1)g | D. | 参加反应镁与氧气的质量比为3:4 |
 ”表示两种物质可以发生反应,用“
”表示两种物质可以发生反应,用“ ”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.
”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.