题目内容
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等; 猜想2:相等。
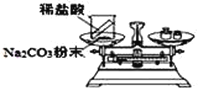
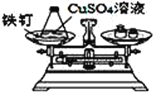
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面 ______,溶液____,天平指针___偏转。 |
结论 | 猜想1正确。有关反应的方程式是:Na2CO3+2HCl | 猜想2正确。反应的化学方程式:__________________ |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在___容器中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下两种改进,
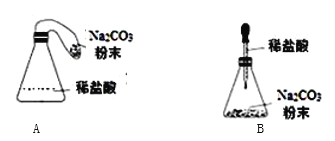
你认为最佳装置是______(填序号),理由是__________。
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:___的各物质的质量总和等于反应后生成的各物质的质量总和。
(解释应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由______种元素组成。
【答案】覆盖一层红色物质 逐渐变成浅绿色 没有(或“不”) Fe + CuSO4 === FeSO4 + Cu 密闭 A A中气球收集产生的气体,使质量守恒(或B中产生气体可能导致气压过大而冲塞等合理表达的答案) 4
【解析】
实验探究:由于铁的活泼性大于铜,铁与硫酸铜反应生成了铜和硫酸亚铁,所以将铁钉放入硫酸铜溶液中发生反应的现象是铁钉表面有一层红色固体生成,溶液由蓝色变为浅绿色, 反应没有气体生成,空气中的物质也没有参与,反应前后质量一样,天平仍然平衡,所以指针不发生偏转;反应的化学方程式为Fe + CuSO4 === FeSO4 + Cu。
反思评价:有气体生成或参加的反应一定要在密闭容器中进行,否则气体会影响实验结果。
优化装置:最佳装置是A,A装置中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,反应后天平能平衡,B中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出。
得出结论:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
解释应用:因为化学反应前后元素的种类不变,氧化铜、二氧化碳和水含有铜、碳、氧、氢四种元素,所以该化合物中也会含有这四种元素。

 名校课堂系列答案
名校课堂系列答案