题目内容
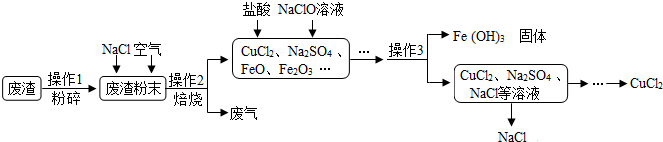
8. 在实验室用如图所示装置进行CO和CO2的分离和干燥.现只有稀盐酸、浓硫酸、氢氧化钠溶液,按要求填写下列空白.
在实验室用如图所示装置进行CO和CO2的分离和干燥.现只有稀盐酸、浓硫酸、氢氧化钠溶液,按要求填写下列空白.操作过程:应先关闭 b,再打开 a,乙中排出CO气体.若获得另一种气体,丙中盛放的溶液为稀盐酸,操作为关闭a,打开b,此刻甲中反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
分析 CO与氢氧化钠溶液不反应,CO2氢氧化钠可反应生成碳酸钠,碳酸钠和盐酸反应可生成二氧化碳,浓硫酸具有吸水性,可干燥气体,且气体从溶液中出来时要带来部分水蒸气,故乙瓶中盛放的是浓硫酸,据此分析实验步骤,并依据反应原理书写方程式.
解答 解:要将CO和CO2分离,可在甲中装有NaOH溶液,用来吸收CO2,先分离出被乙中浓硫酸干燥过的纯净的CO,所以关闭b,打开a,混合气体进入甲装置,CO与氢氧化钠溶液不反应,可分离出 被乙中浓硫酸干燥过的纯净的CO;
二氧化碳与氢氧化钠溶液在甲中反应生成碳酸钠,要得到CO2,可在丙中盛放稀盐酸,然后关闭活塞a,打开b,从丙处加入稀盐酸,稀盐酸与碳酸钠可反应生成氯化钠、水和二氧化碳,又可分离出被乙中浓硫酸干燥过的纯净的CO2;反应的化学方程式为 Na2CO3+2HCl=2NaCl+H2O+CO2↑;
故答案为:CO; 稀盐酸; 关闭a,打开b; Na2CO3+2HCl=2 NaCl+H2O+CO2↑.
点评 此题考查了设计实验分离CO与CO2,掌握气体的性质是解答的关键,可先利用气体的性质加入试剂除掉一种物质,而后再把吸收后的物质与其他物质反应制取出开始除掉的气体.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
19. 如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )
如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )
 如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )
如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )| A. | 这四种元素都属于非金属元素 | B. | 这四种元素具有相似的化学性质 | ||
| C. | 1个氯原子的质量约是35.45g | D. | 氟原子核外电子数为9 |
16.下列除去杂质的方法中,正确的是( )
| 选项 | 物质 | 少量杂质 | 除杂质的方法 |
| A | K2CO3溶液 | KCl | 加适量稀盐酸 |
| B | CaCl2溶液 | HCl | 加过量碳酸钙,过滤 |
| C | KCl固体 | MnO2 | 加水溶解,过滤 |
| D | CO2 | CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
3.下表中,除去物质所含杂质的方法不正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | H2 | CO2 | 通过NaOH溶液,再通过浓硫酸 |
| B | NaCl溶液 | NaHCO3溶液 | 加入适量稀盐酸 |
| C | CO2 | CO | 通过NaOH溶液,再通过浓硫酸 |
| D | 铜粉 | 铁粉 | 用磁铁吸附 |
| A. | A | B. | B | C. | C | D. | D |
13.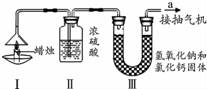 为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
(1)该实验中测得水的质量为1.8g,二氧化碳的质量为4.4g.
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为6:1
(3)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量.
(4)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?不能(填“能”或“不能”),理由是空气中的水和二氧化碳也能被装置Ⅱ、装置Ⅲ吸收.
 为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216. |
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为6:1
(3)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量.
(4)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?不能(填“能”或“不能”),理由是空气中的水和二氧化碳也能被装置Ⅱ、装置Ⅲ吸收.

 如图是A、B、C三种物质的溶解度曲线,请回答:
如图是A、B、C三种物质的溶解度曲线,请回答: