题目内容
3.某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案,实现废物综合利用.部分实验流程如下: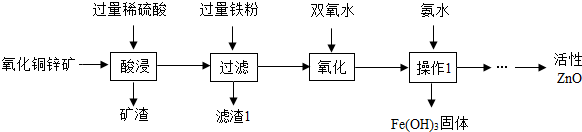
请根据上述实验流程回答下列问题:
(1)操作1的名称是过滤.
(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为ZnO+H2S04═ZnS04+H20,CuO+H2SO4=CuSO4+H2O.
(3)加过量铁粉后,发生反应的基本反应类型是置换反应,得到滤渣1的成分为Fe、Cu(填化学式).
(4)在实验过程中,双氧水会与Fe2+反应生成Fe3+和水,以便在后续的操作中将溶液中铁元素除去.高锰酸钾溶液也能将Fe2+氧化成Fe3+,选用双氧水的优点是不引入较难除去的杂质.
分析 (1)根据实验操作的名称分析;
(2)根据反应物、生成物及质量守恒定律分析解答;
(3)根据基本反应类型的不同特征分析,根据溶液中的固体成份分析;
(4)根据除杂实验的注意事项分析;
解答 解:(1)操作1是将液体和固体分离的操作,是过滤,故填:过滤;
(2)氧化铜锌矿的主要成份是氧化铜和氧化锌,金属氧化物与酸反应生成盐和水,其反应的化学方程式为:ZnO+H2S04═ZnS04+H20,CuO+H2SO4=CuSO4+H2O;故填:ZnO+H2S04═ZnS04+H20,CuO+H2SO4=CuSO4+H2O;
(3)加过量铁粉后,发生的反应是铁和硫酸铜的反应,生成铜和硫酸亚铁,符合置换反应的特征,由于铁粉过量,所以滤渣1的成份是铁和铜,故填:置换反应;Fe、Cu;
(4)除杂实验过程中,要注意不要引入新的杂质,特别是难除去的杂质,双氧水只含有氢和氧两种元素,会与Fe2+反应生成Fe3+和水,而不引入难除掉的其它杂质,故填:不引入较难除去的杂质;
点评 本题看上去是一道分析推断图框题,但题目考查的知识点全是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
12.下列各组物质的溶液,不用其它试剂,仅通过观察和用组内溶液相互混合的方法,不能将它们一一鉴别出来的是( )
| A. | NaOH、Ca(OH)2、HCl、K2CO3 | B. | NaCl、BaCl2、CuSO4、NaOH | ||
| C. | Ba(OH)2、NaCl、Na2SO4、Na2CO3 | D. | AgNO3、HCl、Na2CO3、CaCl2 |
11.学生在做“酸、碱、盐之间能否反应”的探究实验时,用到了H2SO4、Ba(NO3)2、KOH 和 K2CO3 四种溶液.实验结束后,所有的废液集中在一个大烧杯中,观察到废液呈白色浑浊.为了防止污染环境,化学实验小组将废液进行过滤.
【对滤渣的猜想】
小东认为:滤渣中只有 BaSO4.
小西认为:滤渣中只有 BaCO3.
你认为:滤渣中含有BaSO4 和BaCO3 .
【实验探究一】证明你自己的猜想成立的操作方法和现象是:
【对滤液的猜想】小青认为:滤液中含有KNO3、K2CO3、KOH.
小黄认为:滤液中含有KNO3、K2SO4、H2SO4.
小兰认为:滤液中含有KNO3、Ba(NO3)2、KOH.
小红认为:滤液中含有KNO3、K2SO4、Ba(NO3)2、KOH.
大家讨论后一致认为小红的猜想一定不成立,理由是:Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3(用化学方程式表示).
【资料提供】K2CO3溶液显碱性.
【实验探究二】

【实验现象及结论】
(1)根据实验①,小黄的猜想不成立.
(2)根据实验②,若小兰的猜想不成立,现象a为没有白色沉淀.
(3)根据实验③,若小青的猜想成立,X溶液可能是CaCl2溶液,现象b为溶液变红色.
【对滤渣的猜想】
小东认为:滤渣中只有 BaSO4.
小西认为:滤渣中只有 BaCO3.
你认为:滤渣中含有BaSO4 和BaCO3 .
【实验探究一】证明你自己的猜想成立的操作方法和现象是:
| 实验操作 | 实验现象 |
| 取少量滤渣于试管中,加入足量 稀盐酸 | 固体部分溶解,有气泡冒出 |
小黄认为:滤液中含有KNO3、K2SO4、H2SO4.
小兰认为:滤液中含有KNO3、Ba(NO3)2、KOH.
小红认为:滤液中含有KNO3、K2SO4、Ba(NO3)2、KOH.
大家讨论后一致认为小红的猜想一定不成立,理由是:Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3(用化学方程式表示).
【资料提供】K2CO3溶液显碱性.
【实验探究二】

【实验现象及结论】
(1)根据实验①,小黄的猜想不成立.
(2)根据实验②,若小兰的猜想不成立,现象a为没有白色沉淀.
(3)根据实验③,若小青的猜想成立,X溶液可能是CaCl2溶液,现象b为溶液变红色.
18. 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
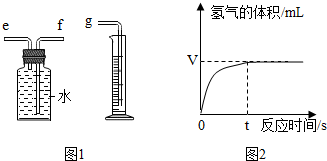
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是根据进入量筒中水的体积,判断生成氧气的体积,氧气应从e(选填e或f)管通入,再与g相连.
【数据处理】
(3)实验小组进行实验后,获得的相关实验数据如表所示:
①若要检验上述实验收集到的气体是否为氧气,方法是将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气.
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是ad(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快.
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快.
【拓展延伸】
(4)如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是随着反应过氧化氢的质量分数变小,反应速度变慢.
(5)你认为影响过氧化氢分解反应速率的因素还有催化剂种类,请设计实验方案验证你的猜想取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是根据进入量筒中水的体积,判断生成氧气的体积,氧气应从e(选填e或f)管通入,再与g相连.
【数据处理】
(3)实验小组进行实验后,获得的相关实验数据如表所示:
| 实验编号 | 过氧化氢的质量分数 (均取10mL) | 二氧化锰粉末 的质量 | 氧气的体积(mL) (均收集5秒钟) |
| a | 5% | 0.2g | 65.8 |
| b | 5% | 0.8g | 85.7 |
| c | 5% | 1.0g | 85.7 |
| d | 10% | 0.2g | 121.9 |
| e | 10% | 0.8g | 171.5 |
| f | 10% | 1.0g | 171.5 |
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是ad(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快.
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快.
【拓展延伸】
(4)如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是随着反应过氧化氢的质量分数变小,反应速度变慢.
(5)你认为影响过氧化氢分解反应速率的因素还有催化剂种类,请设计实验方案验证你的猜想取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
15. 甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
 甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )| A. | 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠 | |
| B. | 若甲、乙、丁都是氧化物,则丙一定是碳酸钙 | |
| C. | 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现 | |
| D. | 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳 |

 A-F是初中化学常见的化合物,其转化关系如图所示,其中A,B,C都是氧化物,B能使澄清石灰水变浑浊,F是一种不溶于水的蓝色固体,图中“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出).请回答:
A-F是初中化学常见的化合物,其转化关系如图所示,其中A,B,C都是氧化物,B能使澄清石灰水变浑浊,F是一种不溶于水的蓝色固体,图中“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出).请回答: