题目内容
4.化学就在我们身边,它能改善我们的生活.请从①小苏打 ②熟石灰 ③二氧化碳 ④食盐”中选择适当的物质的序号填空.(1)可用作改良酸性土壤的物质是②;
(2)焙制糕点所用的发酵粉的主要成分之一的是①.
分析 物质的用途主要取决于物质的性质,先了解物质的性质,再推断其用途.小苏打能和酸反应生成气体,熟石灰和可以与酸反应.
解答 解:
(1)改良酸性土壤需用碱性物质,而熟石灰是一种廉价的碱,所以常用来改良酸性土壤;
(2)小苏打能与面发酵产生的酸反应生成二氧化碳气体,使食品疏松多孔,松软可口,所以属于发酵粉成分之一的是 ①;
故答案为:
(1)②;(2)①.
点评 熟练掌握物质的性质,并把物质的用途与其性质联系起来是解答此类题的关键.

练习册系列答案
相关题目
20.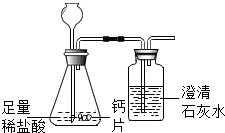 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,有二氧化碳生成.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据右图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止二氧化碳气体溢出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
【分析和评价】
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,有二氧化碳生成.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据右图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止二氧化碳气体溢出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
9.某日某化工厂发生液态氯气泄漏爆炸,次日,另一食品厂制冷车间管道破裂,导致大量液态氨气泄漏.小明通过查阅资料,发现氯气与氨气具有如下表所示的性质.因此,小明认为,消防队员向泄漏的氯气与氨气最好喷洒( )
| 化学式 | 式量 | 性 质 | |||
| Cl2 | 71 | 黄绿色 | 微溶于水,极易溶于碱溶液 | 不易扩散,易沉积 | 剧毒 |
| NH3 | 17 | 无色 | 极易溶于水,能与酸反应 | 易扩散 | 有毒 |
| A. | 都用水 | B. | 都用石灰水 | C. | 石灰水与稀硫酸 | D. | NaOH固体与水 |
16.在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,请根据此推断密闭容器中发生的化学反应的基本类型为( )
| 物质 | A | B | C | D |
| 反应前质量(克) | 24.5 | 2.0 | 1.0 | 8.0 |
| 反应后质量(克) | 0 | 16.9 | 待测 | 8.0 |
| A. | 分解反应 | B. | 化合反应 | C. | 置换反应 | D. | 复分解反应 |
13. 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
(4)【拓展应用】碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多.但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情..
 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
| 实 验 操 作 | 预期现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3 |
