题目内容
14.某样品为Cu和CuO的混合物,为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一种样品分别进行实验,测得的数据如下表:| 学 生 物 质 质 量 | 甲 | 乙 | 丙 | 丁 |
| 所取固体样品的质量(g) | 30 | 25 | 20 | 20 |
| 加入硫酸溶液的质量(g) | 100 | 100 | 100 | 120 |
| 反应后剩余固体的质量(g) | 22 | 17 | 12 | 12 |
(1)样品中氧化铜的质量分数;
(2)求硫酸溶液中溶质的质量分数;
(3)实验中第丙次是完全反应的;
(3)求丁同学实验反应所得硫酸铜溶液的质量分数.
分析 根据金属活动性铜活动性处于H之后,不能与稀硫酸反应,因此铜和氧化铜的混合物加入稀硫酸,只有氧化铜与硫酸发生反应;分析表中数据找出恰好完全反应的实验数据进行计算.
解答 解:由表中数据对比分析:丙中反应前固体是20g,反应后固体是12g,故反应的氧化铜质量为8g,由丁和丙对比,固体混合物相同,酸由100g增加到120g,反应掉的氧化铜仍为8g,说明20g混合物中只含8g氧化铜.由乙丙对比固体混合物质量不同,酸相同,而反应掉的氧化铜相同都是8g,说明25g混合物中的氧化铜没有全部反应,即100g稀硫酸能与20g混合物中的8g氧化铜恰好完全反应.所以甲乙两同学硫酸量不足,丙同学恰好完全反应,丁同学酸剩余.
(1)丙同学的实验中,混合物为20g,剩余固体为12g,所以样品中有8g的氧化铜参加了反应;
混合物中氧化铜的质量分数=$\frac{8g}{20g}$×100%=40%
(2)设参加反应的硫酸质量为X
CuO+H2SO4═CuSO4+H2O
80 98
8g X
$\frac{80}{8g}=\frac{98}{X}$
X=9.8g
硫酸的质量分数:$\frac{9.8g}{100g}$×100%=9.8%
(3)四位同学中,甲乙两位同学所取的硫酸溶液质量不足,丁同学的硫酸过量,故丙是完全反应的,故填:丙;
(4)设生成硫酸铜的质量为x
CuO+H2SO4═CuSO4+H2O
80 160
8g x
$\frac{80}{160}=\frac{8g}{x}$
x
=16g
丁同学实验反应所得硫酸铜溶液的质量分数为:$\frac{16g}{8g+120g}×100%$=12.5%
答:(1)样品中氧化铜的质量分数为40%;
(2)硫酸溶液中溶质的质量分数为9.8%;
(3)丙;
(3)丁同学实验反应所得硫酸铜溶液的质量分数为12.5%.
点评 本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. | 乙炔+氧气$\stackrel{点燃}{→}$二氧化碳+水 | |
| B. | 红磷+氧气$\stackrel{点燃}{→}$五氧化二磷 | |
| C. | 高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气 | |
| D. | 分离液态空气得氮气和氧气 |
(1)石油、煤、天然气合称为三大化石燃料.
①煤燃烧时排放出SO2、NO2等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水会形成酸雨.
②2014年青奥会在南京举行,为了控制汽车尾气给空气造成的污染,我市在燃料的使用和管理等方面采取了一些有效措施,如节能环保车的使用,这也是未来的发展趋势.
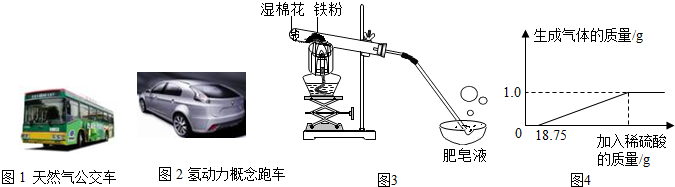
图2是我国自行研制的氢动力概念跑车.汽车最理想的清洁燃料是氢气,但氢动力汽车目前还不能普及的原因是氢气制取成本高或贮存困难(只需写出一点).
(2)水是地球上最普通、最常见的物质之一.
①自来水厂净化水的步骤一般有加絮凝剂、沉淀、过滤、活性炭吸附、消毒剂消毒等步骤.检验自来水是否为硬水常用的物质是肥皂水.生活中通过煮沸的方法可以降低水的硬度.实验室配制氯化钠溶液应该用蒸馏水(填“自来水”或“蒸馏水”).
②从社会角度看:2014年3月22-28日是第二十七届“中国水周”.活动的宣传主题为“节约保护水资源,大力建设生态文明”.下列做法符合宣传主题的是AB.
A.富含氮、磷的生活污水不能排放到河中 B.农业浇灌推广使用喷灌、滴灌技术
C.不间断地放水洗衣服 D.工业污水直接压入地下
③新型自来水净水剂ClO2可由如下反应制取:Cl2+2X═2NaCl+2ClO2,X的化学式为NaClO2.
(3)人类每年都要从大自然中提取大量的金属,用于工农业生产和其他领域.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
①用下列试剂验证这三种金属的活动性顺序,能达到目的是B(填序号).
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
②某工厂的废液中含有硝酸银和硝酸铜,为回收资源和防止污染,向废液中加入一定量的铁粉,反应停止后过滤,向滤渣中加入稀盐酸,无气体产生.
下列说法正确的是A(选填字母).
A.滤渣中一定含有银,可能含有铜
B.滤渣中一定含有银和铜,一定没有铁
C.滤液中一定含有硝酸亚铁,一定没有硝酸银
D.滤液中一定含有硝酸亚铁,一定没有硝酸铜
③常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如图3实验探究铁粉与水蒸气反应后的产物.
a.试管尾部放一团湿棉花的目的是提供水蒸气.
b.探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是H2.
c.探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是Fe3O4.
【实验探究】
| 实验操作 | 实验现象及结论 |
【反思与交流】该黑色固体不可能是Fe2O3,理由是Fe2O3红棕色粉末且不能被磁铁吸引.
④某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图4所示.所得溶液中所含溶质的化学式为Fe2(SO4)3、FeSO4,计算溶液中硫酸铁的质量.(要求写出计算过程)
①浓硫酸 ②浓盐酸 ③纯碱 ④烧碱 ⑤生石灰.
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①④⑤ | D. | ①④ |
| A. | Cl:氯气 | B. | Hg2:氦气 | C. | K2CO3:碳酸钾 | D. | Fe(OH)2:氢氧化铁 |
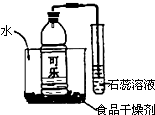 如图是某化学兴趣小组的同学设计的一个趣味实验,其中食品干燥剂的主要成分为生石灰,杂质不考虑.请回答:
如图是某化学兴趣小组的同学设计的一个趣味实验,其中食品干燥剂的主要成分为生石灰,杂质不考虑.请回答: