题目内容
15.金属镁可与热水反应生成氢氧化镁,所得溶液呈碱性,可使酚酞溶液显红色.某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了.(1)金属镁与热水反应的化学方程式为:Mg+2H2O(热)=Mg(OH)2+H2↑;
(2)溶液的红色褪去说明溶液的碱性消失;
(3)据你推测,导致溶液碱性变化的原因是:①氢氧化镁的溶解度随着温度的降低而减小,从而使溶液碱性消失; ②吸收了空气中的二氧化碳而使溶液碱性消失;
(4)(2分)设计一个实验来验证你的一种推测,简要说明操作、现象及结论.
分析 根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
显碱性的溶液能使酚酞试液变红色,显中性或显酸性的溶液不能使酚酞试液变色;
氢氧化镁的溶解度随着温度的降低而减小;
溶解的氢氧化镁能和二氧化碳反应生成碳酸镁沉淀和水;
通过对比可以判断推测是否正确.
解答 解:(1)金属镁与热水反应的化学方程式为:Mg+2H2O(热)=Mg(OH)2+H2↑.
故填:Mg+2H2O(热)=Mg(OH)2+H2↑.
(2)溶液的红色褪去说明溶液的碱性消失.
故填:消失.
(3)导致溶液碱性变化的原因可能是:氢氧化镁的溶解度随着温度的降低而减小,从而使溶液碱性消失;也可能是:吸收了空气中的二氧化碳而使溶液碱性消失.
故填:氢氧化镁的溶解度随着温度的降低而减小,从而使溶液碱性消失;吸收了空气中的二氧化碳而使溶液碱性消失.
(4)实验操作:取上述等量的红色溶液分别与空气接触和隔绝空气的条件下冷却;
实验现象:与空气接触的酚酞试液不褪色,隔绝空气的条件下冷却的酚酞试液褪色;
实验结论:导致溶液碱性变化的原因是氢氧化镁的溶解度随着温度的降低而减小,从而导致溶液的碱性消失.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
6.下列实验对应现象的描述错误的是( )
| A. |  铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出大量的热.产生黑色固体 | |
| B. |  二氧化碳缓缓倒入放有高低两支燃着的蜡烛的烧杯里:下层的蜡烛火焰先熄灭,上层的蜡烛火焰后熄灭 | |
| C. |  电解水的实验:两个电极上产生大量的气泡,正极上产生的是氢气,负极上产生的是氧气 | |
| D. |  测定空气成分的实验:玻璃管内红色的固体粉末变成黑色,气体的总体积减少了约1/5 |
19.同学们运用对比的学习方法探究碱的性质.
(1)由如图实验一、二可知,氢氧化钠会吸收空气的二氧化碳、水,因此要密封保存.
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O,对比A瓶与C(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别饱和氢氧化钠溶液与饱和氢氧化钙溶液(分别编号为A、B).
实验一 | 实验二 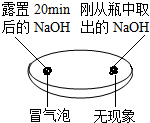 | 实验三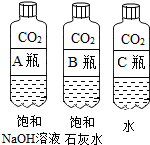 |
| 观察固体表面 | 向两块固体表面滴加稀盐酸 | 振荡三个塑料瓶 |
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O,对比A瓶与C(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别饱和氢氧化钠溶液与饱和氢氧化钙溶液(分别编号为A、B).
| 方案一 | 方案二 | 分析 |
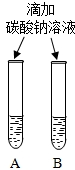 | 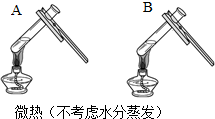 | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为饱和氢氧化钙溶液; 方案二的A溶液变浑浊的原因是氢氧化钙的溶解度随温度升高而减少;氢氧化钠的溶解度随温度升高而升高;两者的溶解度受温度影响情况不同 |
6.逻辑推理是一种重要的思维方法,以下推理合理的是( )
| A. | 因为碱溶液呈碱性,所以呈碱性的溶液一定都是碱溶液 | |
| B. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| C. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成中一定含有碳、氢元素 | |
| D. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 |
2.下列物质的化学式,书写错误的是( )
| A. | 五氧化二磷 P2O5 | B. | 硝酸锌 ZnNO3 | C. | 硫酸钠 Na2SO4 | D. | 氢氧化镁 Mg(OH)2 |


