题目内容
12.我区某校化学社团-“拉瓦锡实验室”的活动丰富多彩.他们以“绿色化学”为主题进行了如下活动.他们在实验室废液桶中收集了含有大量FeSO4、CuSO4的废水,为防止废水直接排放到下水道造成重金属污染和浪费.设计了如下回收硫酸亚铁晶体和铜的实验方案:
请回答下列问题:
(1)整个实验过程中多次采用过滤,该操作用到的玻璃仪器有烧杯、漏斗和玻璃棒.
(2)所加物质X是Fe,其加入废水后发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu;溶液Y是稀硫酸;固体A中含有的物质是Cu、Fe.
(3)该小组的同学又收集到一些含硝酸银、硝酸铜的混合废液,同学们向其中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色.则有关判断正确的是D
A.滤渣中一定有银,没有铜和锌
B.滤渣中一定有银和锌,可能有铜
C.滤渣中一定有硝酸锌、硝酸铜、硝酸银
D.滤渣中一定有硝酸锌、硝酸铜,可能有硝酸银.
分析 废液中回收硫酸亚铁晶体和铜,分析实验方案,明确回收原理及操作方法,完成实验的反应原理、所需仪器及过滤与结晶的操作.由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁.
解答 解:
(1)过滤是将不溶性固体从溶液中分离出来的操作,组装过滤器需要的仪器有:铁架台、漏斗、滤纸、烧杯和玻璃棒.故答案为:漏斗;
(2)为回收废液中的Cu2+需加入活动性在铜前面的金属进行置换,但要得到较为纯净FeSO4的溶液,只能向废液中加入过量的铁粉与硫酸铜发生置换反应,生成物中只有硫酸亚铁,加入其它金属溶液中又混有其它溶质.加入过量铁粉是为了将铜离子全部置换出来.铜排在氢后面,不与酸反应,而铁排在氢前面,与酸反应,因此为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可.
(3)根据三种金属活动性由强到弱的顺序:锌>铜>银,当把锌粉加入到硝酸铜和硝酸银的混合溶液中时,银首先被置换出来,在银完全置换后,铜才能被置换出来;一定量的锌粉,可能完全转换出银,也可能只置换出部分的银,滤液呈蓝色,说明滤液中含有硝酸铜,锌可能没有置换出铜,有可能置换出部分铜;
故答案为:
(1)漏斗;
(2)Fe(或铁),Fe+CuSO4=FeSO4+Cu;稀硫酸;Cu、Fe;(3)D
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.金属活动顺序表是解决与金属相关变化的重要工具,表中H元素为标志性参考元素,H之前为活泼金属,H之后金属性质不活泼.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
3. 某两种物质在光照条件下能发生化学反应,其微观示意图如图所示:(说明:一种小球代表一种元素的原子)下列关于从此图中获取得信息描述正确的是( )
某两种物质在光照条件下能发生化学反应,其微观示意图如图所示:(说明:一种小球代表一种元素的原子)下列关于从此图中获取得信息描述正确的是( )
 某两种物质在光照条件下能发生化学反应,其微观示意图如图所示:(说明:一种小球代表一种元素的原子)下列关于从此图中获取得信息描述正确的是( )
某两种物质在光照条件下能发生化学反应,其微观示意图如图所示:(说明:一种小球代表一种元素的原子)下列关于从此图中获取得信息描述正确的是( )| A. | 图中的反应物都是单质 | B. | 该反应属于化合反应 | ||
| C. | 图示中共有4种物质 | D. | 该反应不符合质量守恒定律 |
20.下列描述与事实相符合的是( )
| A. | 细铁丝伸入盛有氧气的集气瓶中剧烈燃烧 | |
| B. | 电解水实验,电源正极产生的气体燃烧时会发出淡蓝色火焰 | |
| C. | 镁带在空气中燃烧,发出耀眼的白光,生成白色固体 | |
| D. | 铜丝插入硫酸铝溶液中,溶液由无色变为蓝色 |
17.生活中的一些变化主要是物理变化的是( )
| A. |  水面上的铁丝变红 | B. |  沐浴露的乳化作用 | ||
| C. |  钟乳石的形成 | D. |  大米霉变 |
4.a、b、c三种物质在水中的溶解度曲线如图所示,下列有关叙述正确的是( )


| A. | a物质的溶解度大于b物质的溶解度 | |
| B. | 20℃,100g水中最多能溶解10ga物质 | |
| C. | c的饱和溶液质量分数最小 | |
| D. | 降温50℃时b的饱和溶液至20℃,不会析出b物质 |
1.下列过程中主要发生化学变化的是( )
| A. |  洗涤剂洗餐具 | B. |  碱与指示剂的作用 | ||
| C. |  相互刻划 | D. |  金属铜制导线 |
2.6000L氧气在加压的情况下可装入容积为40L的钢瓶中,是因为气体分子( )
| A. | 质量变小 | B. | 体积变小 | C. | 间隔变小 | D. | 个数变少 |

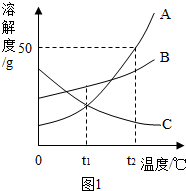 溶解是生活中的常见现象.A、B、C三种物质的溶解曲线如图1所示.
溶解是生活中的常见现象.A、B、C三种物质的溶解曲线如图1所示.