题目内容
19.结合如图所示实验装置回答问题:
(1)检查装置B气密性的方法是将装置中导气管口的乳胶管用止水夹夹住,往长颈漏斗内注入水,若能观察到长颈漏斗中形成一段稳定的液柱,则该装置不漏气.
(2)装置B与C组合,可以制取的一种气体是氧气,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
分析 (1)根据实验室检验装置气密性是形成一个密闭系统进行检验;
(2)根据制取装置和收集方法的特点来分析所制取的气体及其性质.
解答 解:(1)检查装置B气密性的方法是:将止水夹加上,再向长颈漏斗内注入水,就形成了密闭系统,长颈漏斗内液面不下降,说明不漏气;
(2)固液常温下来制取气体,且气体的密度比空气大,可能是氧气,过氧化氢在二氧化锰的催化作用下生成树和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故答案为:(1)将止水夹加上,再向长颈漏斗内注入水,就形成了密闭系统,长颈漏斗内液面不下降,说明不漏气;
(2)氧气,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
9.如图是A、B、C、三种物质的溶解度曲线,下列叙述正确的是( )
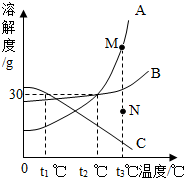

| A. | 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法 | |
| B. | t2℃时,A、C两种物质溶液的溶质的质量分数一定相等 | |
| C. | t2℃时,A、B两种物质的饱和溶液降温到t1℃,析出A的质量更大 | |
| D. | t3℃时,三种物质的溶质质量分数大小顺序为A>B>C |
4.安多夫是一种嫩肉粉,其主要成分碳酸氢钠(NaHCO3)和氯化钠.安多夫可破坏肉质纤维结构、促进肉类吸收水分,从而使肉质松软,达到鲜嫩爽滑的目的.小张发现将拌了安多夫粉的肉类放到锅中加入食醋等调料烧煮时会产生大量的气体,他对此颇感兴趣,决定对其进行探究.
【查阅资料】
1.碳酸氢钠俗称“小苏打”、“苏打粉”、“重曹”,白色细小晶体,加热到50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解.
2.白色无水硫酸铜遇到水会变成蓝色.
【实验探究一】对烧煮时产生的确大量气体的探究
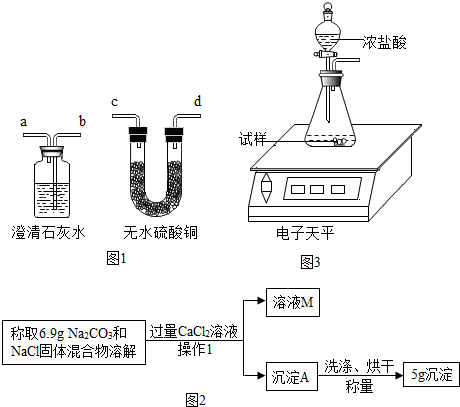
1.小于对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2.他设法收集气体样品并除去醋酸气体后,用右图1实验装置进行验证.装置导
气口连接顺序:气体样品→c→d→b→a
2.小于对二氧化碳的来源作了两种猜测:
猜测①:二氧化碳可能是由醋酸和碳酸氢钠反应产生的;
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的.
针对以上猜测,小于设计了以下实验:
实验结论:猜想①、②都正确
(3)【实验探究二】测定安多夫样品中碳酸氢钠的含量
实验2中,小于发现充分反应后,试管中仍留有一些白色固体粉末,通过查阅资料发现是碳酸钠和氯化钠.小于想用测定白色固体中碳酸钠的质量来推算安多夫样品中碳酸氢钠的含量,于是称取实验2中得到的白色固体粉末6.9克,设计了如下实验方案:如图3
(1)写出“操作1”中任意一种玻璃仪器的名称烧杯,或漏斗,或玻璃棒,实验中加入过量CaCl2溶液的目的是使碳酸钠完全反应.
(2)该安多夫样品中NaHCO3的质量分数是多少?(写出解题过程)
(3)如果沉淀A未经洗涤和干燥会使最终测得NaHCO3的质量分数偏大.
(4)小明同学看到这个设计实验后,提出一个更简单的测定方法,设计思路如下:
①电子天平调零
②检查装置气密性
③装入M克安多夫样品,浓盐酸
④称药品和装置的总质量W1克
⑤滴入浓盐酸
⑥无气泡产生后,再称整个装置的质量W2克
⑦(W2-W1)减轻的质量就是二氧化碳的质量
通过化学方程式计算NaHCO3的质量,最终达到计算安多夫样品中NaHCO3的质量分数的目的.
【方案评价】两位同学经过多次的实验测定后发现,得到的最终结果总是比真实值偏大,请你帮他们分析结果偏大的原因可能是BC.
A.所加酸的量不足
B.实验中使用了浓盐酸
C.未考虑反应过程中水的蒸发
D.未考虑生成的二氧化碳气体残留在装置内如图2.

【查阅资料】
1.碳酸氢钠俗称“小苏打”、“苏打粉”、“重曹”,白色细小晶体,加热到50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解.
2.白色无水硫酸铜遇到水会变成蓝色.
【实验探究一】对烧煮时产生的确大量气体的探究
1.小于对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2.他设法收集气体样品并除去醋酸气体后,用右图1实验装置进行验证.装置导
气口连接顺序:气体样品→c→d→b→a
2.小于对二氧化碳的来源作了两种猜测:
猜测①:二氧化碳可能是由醋酸和碳酸氢钠反应产生的;
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的.
针对以上猜测,小于设计了以下实验:
| 实验步骤 | 实验现象 | |
| 实验1 | 取安多夫样品少许加入试管中,加入醋酸,并把产生的气体通入澄清石灰水 | 产生气泡,澄清石灰水变浑浊 |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |
(3)【实验探究二】测定安多夫样品中碳酸氢钠的含量
实验2中,小于发现充分反应后,试管中仍留有一些白色固体粉末,通过查阅资料发现是碳酸钠和氯化钠.小于想用测定白色固体中碳酸钠的质量来推算安多夫样品中碳酸氢钠的含量,于是称取实验2中得到的白色固体粉末6.9克,设计了如下实验方案:如图3
(1)写出“操作1”中任意一种玻璃仪器的名称烧杯,或漏斗,或玻璃棒,实验中加入过量CaCl2溶液的目的是使碳酸钠完全反应.
(2)该安多夫样品中NaHCO3的质量分数是多少?(写出解题过程)
(3)如果沉淀A未经洗涤和干燥会使最终测得NaHCO3的质量分数偏大.
(4)小明同学看到这个设计实验后,提出一个更简单的测定方法,设计思路如下:
①电子天平调零
②检查装置气密性
③装入M克安多夫样品,浓盐酸
④称药品和装置的总质量W1克
⑤滴入浓盐酸
⑥无气泡产生后,再称整个装置的质量W2克
⑦(W2-W1)减轻的质量就是二氧化碳的质量
通过化学方程式计算NaHCO3的质量,最终达到计算安多夫样品中NaHCO3的质量分数的目的.
【方案评价】两位同学经过多次的实验测定后发现,得到的最终结果总是比真实值偏大,请你帮他们分析结果偏大的原因可能是BC.
A.所加酸的量不足
B.实验中使用了浓盐酸
C.未考虑反应过程中水的蒸发
D.未考虑生成的二氧化碳气体残留在装置内如图2.
11.下列变化是化学变化的是( )
| A. | 矿石粉碎 | B. | 蜡融化 | C. | 食物腐烂 | D. | 液化空气制氧 |
9.下列反应属于复分解反应的是( )
| A. | Fe2O3+3CO$\stackrel{高温}{→}$2Fe+3CO2 | B. | 2NaOH+H2SO4→Na2SO4+2H2O | ||
| C. | C+O2$\stackrel{点燃}{→}$CO2 | D. | CH4+2O2$\stackrel{点燃}{→}$2H2O+CO2 |
