题目内容
17.安庆高新技术开发区是国家级重点化工基地,园区的泰发新能源科技公司以煤为原料进行如图所示的流程处理,使煤变为清洁能源并生产出其它化工产品.
(1)第②步是精煤与水蒸气的反应,其反应类型是置换反应.
(2)第②步生成的产物除了直接做气体燃料和制取甲醇外,还可以利用它们的还原性来冶炼金属,写出其中一种气体与氧化铁发生反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)甲醇与乙醇一样具有可燃性,是一种理想的清洁能源,写出甲醇充分燃烧的化学方程式2CH3OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O;.
(4)直接燃煤与煤的深加工综合利用你认为的优点是原料全部转化为产品或实现“零排放”,不对环境造成污染(答一点即可)
分析 (1)根据基本反应类型的特点分析;
(2)根据氢气和一氧化碳具有还原性进行分析;根据一氧化碳能与氧化铁反应,生成了铁和二氧化碳进行分析;
(3)根据甲醇在空气里充分燃烧生成二氧化碳和水分析解答;
(4)根据原料的利用和对环境的影响分析解答.
解答 解:(1)第②步是精炼煤与水蒸气的反应,在高温条件下生成了氢气和一氧化碳,反应化学方程式为:H2O+C$\frac{\underline{\;高温\;}}{\;}$ H2+CO;其反应物和生成物均为一种单质和一种化合物,所以该反应属于置换反应;
(2)氢气和一氧化碳都具有还原性;一氧化碳能与氧化铁反应,生成了铁和二氧化碳.反应的方程式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)甲醇在空气里充分燃烧生成二氧化碳和水,反应的化学方程式为:2CH3OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O;
(4)从“绿色化学”的角度分析,“煤的气化和煤的液化”生产流程的优点是:原料全部转化为产品或实现“零排放”,不对环境造成污染.
故答案为:(1)置换反应;(2)还原;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(3)2CH3OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O;(4)原料全部转化为产品或实现“零排放”,不对环境造成污染.
点评 本题通过煤的综合利用,属于基础的知识,难度不大.根据已有的知识即可解答.

练习册系列答案
相关题目
8.下列自然资源的利用过程中,一定发生了化学变化的是( )
| A. | 水力发电 | B. | 石油分馏 | C. | 海水晒盐 | D. | 煤炭干馏 |
5.过氧化钠是化学中常见的一种药品,为浅黄白色颗粒,在空气中吸收水和二氧化碳,易溶于水,与水发生反应生成氢氧化钠和过氧化氢,接着过氧化氢又能分解放出氧气.
(1)请写出过氧化钠与水反应化学方程式2Na2O2+2H2O=4NaOH+O2↑
(2)请写出区别水和过氧化氢的方法分别取两种液体少许放入两支洁净的试管中,分别加入少量的二氧化锰,有大量气泡产生的液体是过氧化氢溶液,无明显现象的液体是水
(3)某同学为了证明过氧化钠与水反应生成了氢氧化钠,在反应后的溶解中滴加几滴无色酚酞溶液,发现溶液变成了红色,可是过一会儿红色消失了
【提出问题】什么原因导致溶液先变红再褪为无色
【猜想与假设】
猜想1:可能是无色酚酞溶液变质导致溶液褪色
猜想2:可能生成的过氧化氢使溶液褪色
【实验与结论】
①猜想1立即遭到其他同学的反对,因为如果是无色酚酞溶液变质,刚开始就不会先变成红色了
②为了验证猜想2,同学们设计了如表方案并验证
【讨论交流】老师提醒同学还有其他原因也会导致溶液先变红再褪为无色你认为可能还与氢氧化钠溶液浓度过大有关.(写一条即可)
【实验方案】
(1)请写出过氧化钠与水反应化学方程式2Na2O2+2H2O=4NaOH+O2↑
(2)请写出区别水和过氧化氢的方法分别取两种液体少许放入两支洁净的试管中,分别加入少量的二氧化锰,有大量气泡产生的液体是过氧化氢溶液,无明显现象的液体是水
(3)某同学为了证明过氧化钠与水反应生成了氢氧化钠,在反应后的溶解中滴加几滴无色酚酞溶液,发现溶液变成了红色,可是过一会儿红色消失了
【提出问题】什么原因导致溶液先变红再褪为无色
【猜想与假设】
猜想1:可能是无色酚酞溶液变质导致溶液褪色
猜想2:可能生成的过氧化氢使溶液褪色
【实验与结论】
①猜想1立即遭到其他同学的反对,因为如果是无色酚酞溶液变质,刚开始就不会先变成红色了
②为了验证猜想2,同学们设计了如表方案并验证
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后往试管中滴加过氧化氢溶液观察现象观察现象 | 溶液由红色变为无色 | 不是过氧化氢使溶液颜色褪色 |
【实验方案】
| 实验步骤 | 可能出现的实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量水,观察现象 | (1)变回红色; (2)依然无色 | (1)氢氧化钠溶液浓度过大导致溶液颜色褪去; (2)溶液颜色褪去与氢氧化钠溶液浓度无关 |
12.下列实验操作能达到实验目的是( )


| A. | ①实验可以验证质量守恒定律 | |
| B. | ②实验中可以证明金属活动性为Fe>Cu>Ag | |
| C. | ③U形管中液面变化可以鉴别氯化钠和氢氧化钠 | |
| D. | ④中根据小气球变大可以证明氢氧化钠与二氧化碳发生反应 |
9.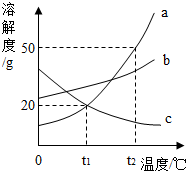 如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )
 如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )| A. | t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c | |
| B. | t1℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液 | |
| C. | 将c的饱和溶液变为不饱和溶液,可采用降温的方法 | |
| D. | 将t2 时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c |
 某化学学习小组进行了如图所示的实验:反应的化学方程式为(1)H2SO4+BaCl2═BaSO4↓+2HCl.小组同学对B中溶液中溶质的成分继续探究.
某化学学习小组进行了如图所示的实验:反应的化学方程式为(1)H2SO4+BaCl2═BaSO4↓+2HCl.小组同学对B中溶液中溶质的成分继续探究.