题目内容
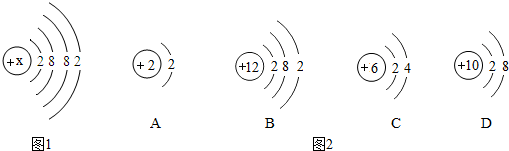
10.氨水(NH3•H2O)是一种液态氮肥,在水溶液中能解离出NH4+(铵离子)和OH-.(1)写出氨水可能具有的2个化学性质:①能使酚酞变红色,②会与酸发生中和反应.
(2)NH3在一定条件下能跟O2反应,反应过程可用如图微观模拟图表示(反应式未配平):

写出NH3与O2反应的化学方程式(并配平):4NH3+5O2$\frac{\underline{\;一定条件\;}}{\;}$6H2O+4NO.
分析 (1)根据碱具有的化学性质进行分析;
(2)根据氨气和氧气在一定条件下反应生成水和一氧化氮进行分析.
解答 解:(1)通过分析碱具有的化学性质可知,氨水可能具有的2个化学性质有:能使酚酞变红色,会与酸发生中和反应;
(2)氨气和氧气在一定条件下反应生成水和一氧化氮,化学方程式为:4NH3+5O2$\frac{\underline{\;一定条件\;}}{\;}$6H2O+4NO.
故答案为:(1)能使酚酞变红色,会与酸发生中和反应;
(2)4NH3+5O2$\frac{\underline{\;一定条件\;}}{\;}$6H2O+4NO.
点评 本题主要考查了氨水的性质,难度不大,注意知识迁移在化学中的应用.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
18.将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)$\stackrel{{O}_{2}}{→}$钠的氧化物$\stackrel{{H}_{2}O}{→}$氢氧化钠溶液$\stackrel{C{O}_{2}}{→}$白色固体
【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
【作出猜想】常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:①Na2O和Na2O2
【实验探究一】
【继续探究】钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】
【实验反思】
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 ⑥Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为⑦O2.
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 ⑧不是碱性氧化物(填“是”或“不是”).
钠(Na)$\stackrel{{O}_{2}}{→}$钠的氧化物$\stackrel{{H}_{2}O}{→}$氢氧化钠溶液$\stackrel{C{O}_{2}}{→}$白色固体
【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
【作出猜想】常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:①Na2O和Na2O2
【实验探究一】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | ②没有气泡生成 | 猜想1正确 |
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量③氯化钡溶液(或氯化钙溶液). | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤、取少量滤液加入 ④无色酚酞试液 | ⑤试液变红 |
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 ⑥Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为⑦O2.
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 ⑧不是碱性氧化物(填“是”或“不是”).
8.下列实验基本操作正确的是( )
| A. |  取用锌粒 | B. |  量取液体 | C. |  检查装置气密性 | D. |  点燃酒精灯 |
9.小明在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了探究.

【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe═Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
请帮助小明完成如表:
【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式Fe+H2SO4═FeSO4+H2↑,写出实验二中发生爆鸣反应的化学方程式2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.
(2)实验一中C装置的作用是吸收二氧化硫.【拓展延伸】小明又将A装置进行了如图丙所示的改进,试分析:增加的导管下端伸入液
面以下原因形成液封,防止生成的气体逸出,该导管所起的作用是平衡试管内外的压强,防止橡皮塞飞出.

【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe═Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
请帮助小明完成如表:
| 实验现象 | |||||
| 硫酸溶液浓度 | B中品红溶液 | D中品红溶液 | 爆鸣实验 | A中生成气体成分 | |
| 实验一 | 98% | 褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | SO2和H2 |
| 实验三 | 25% | 不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式Fe+H2SO4═FeSO4+H2↑,写出实验二中发生爆鸣反应的化学方程式2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.
(2)实验一中C装置的作用是吸收二氧化硫.【拓展延伸】小明又将A装置进行了如图丙所示的改进,试分析:增加的导管下端伸入液
面以下原因形成液封,防止生成的气体逸出,该导管所起的作用是平衡试管内外的压强,防止橡皮塞飞出.

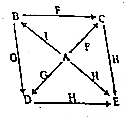 A~I是初中化学常见物质,硫酸亚铁、硫酸、硫酸钠、氧化铜、硫酸钡、氢氧化钠、铁、氯化钡、硫酸铜中的某一种,B是蓝色溶液,E是白色固体、G、I都是黑色的固体,如图是这些物质的转化关系(部分反应物、生成物及反应条件已省略).
A~I是初中化学常见物质,硫酸亚铁、硫酸、硫酸钠、氧化铜、硫酸钡、氢氧化钠、铁、氯化钡、硫酸铜中的某一种,B是蓝色溶液,E是白色固体、G、I都是黑色的固体,如图是这些物质的转化关系(部分反应物、生成物及反应条件已省略).