题目内容
16.生活中处处充满化学,下列生活中的化学知识叙述正确的是( )| A. | 用纯碱溶液除去水壶中的水垢 | |
| B. | 钢铁制品在干燥的空气中易生锈 | |
| C. | 硫酸铜可用于游泳池水消毒,也可用于自来水消毒 | |
| D. | 用聚乙烯塑料制成的包装袋可包装食品 |
分析 A、水垢的主要成分是碳酸钙与氢氧化镁,根据复分解反应发生的条件判断.
B、钢铁生锈的条件是水与氧气.
C、硫酸铜属于重金属盐,饮用后对人体有毒.
D、用聚乙烯塑料制成的包装袋无毒,可用于包装食品.
解答 解:A、水垢的主要成分是碳酸钙与氢氧化镁,纯碱不能与之发生反应,故此选项错误.
B、钢铁生锈的条件是水与氧气,干燥的空气中不易生锈,故此选项错误.
C、硫酸铜饮用后对人体有毒,故不能用于自来水消毒,故此选项错误.
D、用聚乙烯塑料制成的包装袋无毒,可用于包装食品;故此选项正确.
故选:D.
点评 此题是对常见物质的性质进行的考查,只要对不同物质的性质有全面的掌握,就能解决此类题目.

练习册系列答案
相关题目
7.下列关于催化剂的说法中,正确的是( )
| A. | 只有二氧化锰能做催化剂 | |
| B. | 催化剂加快反应速率 | |
| C. | 催化剂不能减缓反应速率 | |
| D. | 反应前后催化剂的化学性质不会改变 |
4.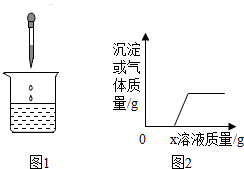 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )| 烧杯中的物质 | x溶液 | |
| A | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |
| B | 需硫酸和稀盐酸 | 氯化钡溶液 |
| C | 黄铜粉末 | 稀盐酸 |
| D | 稀盐酸和硫酸镁溶液 | 烧碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.下列变化属于化学变化的是( )
| A. | 西瓜榨汁 | B. | 干冰升华 | C. | 蜡烛燃烧 | D. | 吹爆气球 |
1.用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.
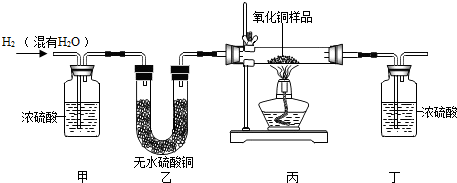
【查阅资料】无水硫酸铜为白色固体,遇水变成蓝色.请根据资料回答:
(1)在实验中,甲装置的作用是除水.
(2)准确称取完全反应前后装置丙和丁的质量如表:
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程).
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大.请分析导致这一结果的原因可能是B.
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原.

【查阅资料】无水硫酸铜为白色固体,遇水变成蓝色.请根据资料回答:
(1)在实验中,甲装置的作用是除水.
(2)准确称取完全反应前后装置丙和丁的质量如表:
| 装置丙 | 装置丁 | |
| 反应前 | 48.8克 | 161.2克 |
| 反应后 | 46.5克 | 163.9克 |
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大.请分析导致这一结果的原因可能是B.
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原.
8.酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应.
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有水生成.
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象.取反应后的部分溶液加热、蒸干、得到白色固体.
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性.请填写下表:
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点.
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质.
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶.请回答:
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充.
(4)工业上常用NaOH溶液处理铝土矿(主要成分为A12O3),反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水).若用160kg NaOH配制的溶液恰好能处理340kg铝土矿,最终得到1004kg NaAlO2溶液.
计算①该铝土矿中A12O3的质量分数.
②加入的NaOH溶液中水的质量.
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有水生成.
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象.取反应后的部分溶液加热、蒸干、得到白色固体.
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性.请填写下表:
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 | pH>7 | |
| CaCl2 |
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质.
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶.请回答:
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充.
(4)工业上常用NaOH溶液处理铝土矿(主要成分为A12O3),反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水).若用160kg NaOH配制的溶液恰好能处理340kg铝土矿,最终得到1004kg NaAlO2溶液.
计算①该铝土矿中A12O3的质量分数.
②加入的NaOH溶液中水的质量.
6.有关如图粒子结构示意图的说法正确的是( )
| A. |  阳离子 | |
| B. |  所属的元素在周期表中一定位于第二周期 | |
| C. |  相对原子质量为12 | |
| D. |  在化学变化中一定易得到电子 |
 如图,将正在萌发的种子,放在内有一杯NaOH溶液而用塞子塞紧的瓶中,此瓶与一个水银流体压力计相连接,由此压力计水银柱升高的高度可以测量出某种气体的消耗量.假设正在萌发的种子用完了瓶中所有的气体,则水银柱会升高到76cm处(等于大气压).
如图,将正在萌发的种子,放在内有一杯NaOH溶液而用塞子塞紧的瓶中,此瓶与一个水银流体压力计相连接,由此压力计水银柱升高的高度可以测量出某种气体的消耗量.假设正在萌发的种子用完了瓶中所有的气体,则水银柱会升高到76cm处(等于大气压).