题目内容
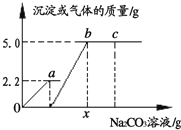
【题目】某同学向盛有大量的盐酸与氯化钙的混合溶液中逐滴滴入Na2CO3溶液至过量。他记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示。下列判断不正确的是
A.图中纵坐标(y)表示生成沉淀的质量
B.反应进行到C点时,溶液中的溶质只有NaCl
C.B点溶液的pH=7
D.OA段发生反应的化学方程式是 Na2CO3+2HCl=2NaCl+H2O+CO2↑
【答案】B
【解析】
试题分析:解答图像类的题目抓住“三点一走势”,即首先看清楚横、纵坐标各表示的量,然后从起始点、转折点、终点还有量的变化趋势来进行分析解答,向盛有大量的盐酸与氯化钙的混合溶液中逐滴滴入Na2CO3溶液至过量,先后反应为:Na2CO3+2HCl==2NaCl+H2O+CO2↑,CaCl2+Na2CO3==CaCO3↓+2NaCl ,A、因为反应刚开始没有沉淀生成,故图中纵坐标(y)表示生成沉淀的质量,正确,B、反应进行到C点时,表示Na2CO3溶液过量,此时溶液中的溶质有NaCl和Na2CO3,错误,C、B点表示两个反应都恰好反应完全,故此时溶液的pH=7,正确,D、OA段发生反应的化学方程式是 Na2CO3+2HCl=2NaCl+H2O+CO2↑,正确,故选B

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目