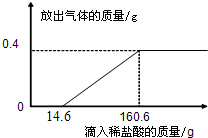
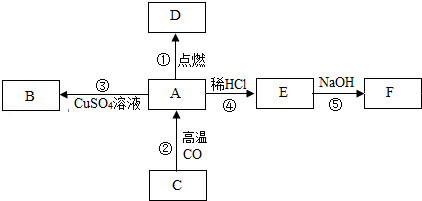
题目内容
请根据常见的金属的知识回答有关问题:(1)写出地壳中含量最多的金属元素的符号______.
(2)解释不能用铁制容器配制硫酸铜溶液的原因(用化学方程式表示)______;
(3)铬、铜及其合金在交通工具上随处可见,现将铬(Cr)插入Cu(NO3)2的溶液中,铬上有红色物质出现.则铬和铜相比,金属活动性强的是______;
(4)目前铝在多个领域替代易生锈的钢铁,其主要原因是______.
(5)若要除去FeCl2溶液中的少量CuCl2杂质,可加入过量的______.
【答案】分析:(1)根据地壳中各元素含量的排序及元素的分类进行分析判断.
(2)铁的活动性比铜强,能与硫酸铜发生置换反应.
(3)根据铬(Cr)插入Cu(NO3)2溶液中,铬上有红色物质析出的现象判断铬是否能置换出硝酸铜中的铜,进而判断金属的活动性顺序.
(4)根据金属铝的化学性质进行分析判断.
(5)除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:解:(1)地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,其元素符号为:Al.
(2)铁的活动性比铜强,能与硫酸铜发生置换反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4.
(3)将铬(Cr)插入Cu(NO3)2的溶液中,铬上有红色物质出现,说明铬能将铜从硝酸铜溶液中置换出来,故铬的活动性比铜强.
(4)铝能和空气中的氧气反应生成致密的氧化铝薄膜具有保护作用,具有良好的抗腐蚀性能.
(5)除去FeCl2溶液中的少量CuCl2杂质,实质就是除铜离子,根据金属活动性顺序,铁的活动性比铜强,可以用过量的铁粉与CuCl2溶液反应,然后过滤除去固体即可得到FeCl2溶液.
故答案为:(1)Al;(2)Fe+CuSO4=Cu+FeSO4;(3)铬(Cr);(4)铝能和空气中的氧气反应生成致密的氧化膜具有保护作用;(5)铁粉.
点评:本题难度不大,掌握金属活动性顺序与金属的化学性质、抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解答本题的关键.
(2)铁的活动性比铜强,能与硫酸铜发生置换反应.
(3)根据铬(Cr)插入Cu(NO3)2溶液中,铬上有红色物质析出的现象判断铬是否能置换出硝酸铜中的铜,进而判断金属的活动性顺序.
(4)根据金属铝的化学性质进行分析判断.
(5)除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:解:(1)地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,其元素符号为:Al.
(2)铁的活动性比铜强,能与硫酸铜发生置换反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4.
(3)将铬(Cr)插入Cu(NO3)2的溶液中,铬上有红色物质出现,说明铬能将铜从硝酸铜溶液中置换出来,故铬的活动性比铜强.
(4)铝能和空气中的氧气反应生成致密的氧化铝薄膜具有保护作用,具有良好的抗腐蚀性能.
(5)除去FeCl2溶液中的少量CuCl2杂质,实质就是除铜离子,根据金属活动性顺序,铁的活动性比铜强,可以用过量的铁粉与CuCl2溶液反应,然后过滤除去固体即可得到FeCl2溶液.
故答案为:(1)Al;(2)Fe+CuSO4=Cu+FeSO4;(3)铬(Cr);(4)铝能和空气中的氧气反应生成致密的氧化膜具有保护作用;(5)铁粉.
点评:本题难度不大,掌握金属活动性顺序与金属的化学性质、抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解答本题的关键.

练习册系列答案
相关题目
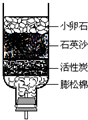 (2010?平谷区一模)水是人类生活中不可缺少的物质.
(2010?平谷区一模)水是人类生活中不可缺少的物质.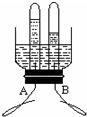
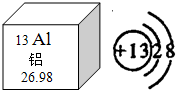 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.