题目内容
 (2010?平谷区一模)水是人类生活中不可缺少的物质.
(2010?平谷区一模)水是人类生活中不可缺少的物质.(1)下列日常生活和生产中常见的水,属于纯净物的是
B
B
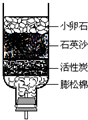
.A.矿泉水;B.蒸馏水;C.河水;D.雨水.(2)如右图所示的简易净化水的装置,运用了如下净水方法中的
B D
B D
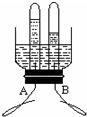
(填序号).A、消毒;B、过滤;C、蒸馏;D、吸附.(3)某同学设计了电解水简易装置,其中A、B电极由金属曲别针制成.通电一段时间后的现象如图所示,则与电源负极相连的是
B
B
电极[填A或B],发生反应的化学方程式为2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
.
| ||
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳.请写出Ca(HCO3)2受热分解的化学方程式
Ca(HCO3)2
CaCO3↓+H2O+CO2↑
| ||
Ca(HCO3)2
CaCO3↓+H2O+CO2↑
;若洁厕灵的主要成分是盐酸,则用洁厕灵除水垢的化学方程式为
| ||
CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.(5)根据上述电解水实验现象,若已知水的相对分子质量为18,标准状况下氢气密度:0.089g/L,氧气密度:1.429g/L.则计算一个水分子中氧原子个数的数学表达式为
18×
÷16
| 1.429g/L×1L |
| 0.089g/L×2L+1.429g/L×1L |
18×
÷16
.| 1.429g/L×1L |
| 0.089g/L×2L+1.429g/L×1L |
分析:物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成.水的净化方法有:消毒、过滤、蒸馏、吸附等;电解水的实验中,是水在通电的条件下生成氢气和氧气,其中是正氧负氢.Ca(HCO3)2受热分解生成碳酸钙和水和二氧化碳;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可.有关原子个数的计算要正确.
解答:解:(1)混合物是由两种或两种以上的物质组成,纯净物是由一种物质组成,蒸馏水属于纯净物,故答案为:B.
(2)如右图所示的简易净化水的装置,小卵石和石英砂起过滤作用,活性炭起吸附作用,故答案为:BD
(3)水在通电的条件下生成氢气和氧气,配平即可,其中是正氧负氢,因此与电源负极相连的是体积比较大的氢气,即B.故答案为:B,2H2O
2H2↑+O2↑
(4)Ca(HCO3)2受热分解生成碳酸钙和水和二氧化碳;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可.故答案为:Ca(HCO3)2
CaCO3↓+H2O+CO2↑;CaCO3+2HCl=CaCl2+CO2↑+H2O.
(5)先根据密度公式的变形公式:m=ρv,求氧元素在一个水分子中占的质量是:
18×
;再根据求原子个数的公式:原子个数=
,可以计算氧原子的个数.
故答案为:18×
÷16
(2)如右图所示的简易净化水的装置,小卵石和石英砂起过滤作用,活性炭起吸附作用,故答案为:BD
(3)水在通电的条件下生成氢气和氧气,配平即可,其中是正氧负氢,因此与电源负极相连的是体积比较大的氢气,即B.故答案为:B,2H2O
| ||
(4)Ca(HCO3)2受热分解生成碳酸钙和水和二氧化碳;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可.故答案为:Ca(HCO3)2
| ||
(5)先根据密度公式的变形公式:m=ρv,求氧元素在一个水分子中占的质量是:
18×
| 1.429g/L×1L |
| 0.089g/L×2L+1.429g/L×1L |
| 质量 |
| 相对原子质量 |
故答案为:18×
| 1.429g/L×1L |
| 0.089g/L×2L+1.429g/L×1L |
点评:本考点考查了有关水的净化、电解水的实验和有关的计算,还考查了化学方程式的书写,综合性比较强,一定要加强记忆,综合掌握.书写方程式时,要注意配平,有关的计算要准确.此类考点主要出现在填空题和实验题中.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目