题目内容
3.观察和实验是学习科学的重要方法,下列实验中观察到的现象正确的是( )| A. | 氯化铁溶液中滴加氢氧化钠溶液出现蓝色絮状沉淀 | |
| B. | 酚酞试液滴入食盐溶液中变蓝色 | |
| C. | 铁锈放入稀硫酸中溶液变蓝色 | |
| D. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 |
分析 A、根据碱的化学性质,进行分析判断.
B、无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红.
C、根据酸的化学性质,进行分析判断.
D、根据硫在氧气中燃烧的现象进行分析判断.
解答 解:A、氯化铁溶液中滴加氢氧化钠溶液,生成氢氧化铁沉淀,出现红褐色絮状沉淀,故选项说法错误.
B、食盐溶液显中性,酚酞试液滴入食盐溶液中变无色,故选项说法错误.
C、铁锈放入稀硫酸中,生成硫酸铁和水,溶液变黄色,故选项说法错误.
D、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法正确.
故选:D.
点评 本题难度不大,掌握碱与酸的化学性质、常见物质燃烧的现象即可正确解答,在描述实验现象时,需要注意生成物的颜色、状态.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
14.中国是世界上最早研究和生产合金的国家之一,在商朝(距今3000多年前)青铜工艺就已非常发达;青铜是除黄铜(铜锌合金)白铜(铜镍合金)外的其余铜合金的统称,镁铜合金属于青铜的一类,某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称量,得到的实验数据如下:
(1)从以上数据可知,表格中,m=2.5
(2)计算合金样品中镁和铜的质量比.
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
(2)计算合金样品中镁和铜的质量比.
11.下列各组物质中,前者是纯净物,后者是混合物的是( )
| A. | 水、冰水混合物 | B. | 纯碱 液态氧 | C. | 臭氧、浓盐酸 | D. | 汽水 氯化钾 |
18. 铁、盐酸、石灰水、硫酸铜是初中化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述不正确的是( )
铁、盐酸、石灰水、硫酸铜是初中化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述不正确的是( )
 铁、盐酸、石灰水、硫酸铜是初中化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述不正确的是( )
铁、盐酸、石灰水、硫酸铜是初中化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述不正确的是( )| A. | A无明显现象产生 | B. | B有红褐色沉淀 | ||
| C. | C有红色固体析出产生 | D. | D有气泡生成 |
8.已知水的沸点随压强的减少而降低.现有如图所示实验装置,夹子开始处于关闭状态.将液体A滴人试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾.则液体A和气体B的组合可能是( )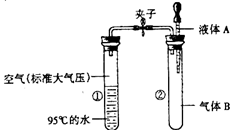

| A. | A为氯化钙溶液,B为二氧化碳气体 | |
| B. | A为氢氧化钠溶液,B为二氧化硫气体 | |
| C. | A为氢氧化钙溶液,B为一氧化碳气体 | |
| D. | A为稀硫酸溶液,B为二氧化碳气体 |
12. 构建知识网络是一种重要的学习方法,如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C分别属于不同类别的化合物,则A,B,C可能是( )
构建知识网络是一种重要的学习方法,如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C分别属于不同类别的化合物,则A,B,C可能是( )
 构建知识网络是一种重要的学习方法,如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C分别属于不同类别的化合物,则A,B,C可能是( )
构建知识网络是一种重要的学习方法,如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C分别属于不同类别的化合物,则A,B,C可能是( )| A. | KOH,HNO3,K2CO3 | B. | NaOH,CuSO4,NaNO3 | ||
| C. | Ba(OH)2,CuSO4,CuO | D. | NaOH,HCl,Ba(NO3)2 |
16.下列仪器中,没有在瓶颈处“磨砂”的是( )
| A. | 广口瓶 | B. | 锥形瓶 | C. | 集气瓶 | D. | 滴瓶 |