题目内容
在托盘天平的两个托盘上各放置一只等质量的烧杯,分别注入足量的等质量的稀盐酸,调节天平平衡.然后向左盘的烧杯中加入6.5g锌.当反应结束后,要失天平仍保持平衡,应向右盘烧杯中加入多少克金属镁?(有关反应化学方程式:Zn+2HCl=ZnCl2+H2↑,Mg+2HCl=MgCl2+H2↑,结果保留一位小数)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据所给的盐酸足量,通过投入的金属的质量可以计算出烧杯中增重的质量,然后结合题意进行判断.
解答:解:Zn+2HCl═ZnCl2+H2↑ 增重
65 63
6.5g 6.3g
通过化学方程式可以看出,6.5克的锌与盐酸反应后,溶液质量增重6.3克,所以
设:要使天平仍保持平衡,应向右盘烧杯中加入金属镁的质量是x,
Mg+2HCl=MgCl2+H2↑ 增重
24 22
x 6.3g
=
x≈6.9g
答:应向右盘烧杯中加入约6.9克金属镁.
65 63
6.5g 6.3g
通过化学方程式可以看出,6.5克的锌与盐酸反应后,溶液质量增重6.3克,所以
设:要使天平仍保持平衡,应向右盘烧杯中加入金属镁的质量是x,
Mg+2HCl=MgCl2+H2↑ 增重
24 22
x 6.3g
| 24 |
| 22 |
| x |
| 6.3g |
x≈6.9g
答:应向右盘烧杯中加入约6.9克金属镁.
点评:本题主要考查了金属与酸反应的计算问题,难度不大,依据学过的化学方程式和题中的数据即可解答.

练习册系列答案
相关题目
Cr2O3可以作某些反应的催化剂,其中Cr元素的化合价为( )
| A、+3 | B、+4 | C、+5 | D、+6 |
运用100mL量筒进行相关实验,操作正确的是( )
A、 量取20.2mL水 |
B、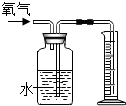 收集80mL氧气 |
C、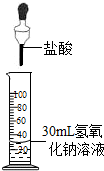 30mL氢氧化钠溶液中滴入盐酸 |
D、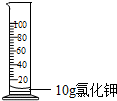 配制100g10%的氯化钾溶液 |
把下列各组物质的溶液混合,再加入足量的稀盐酸,最终有沉淀残留的是( )
| A、Ba(NO3)2、Na2CO3 |
| B、BaCl2、H2SO4 |
| C、KNO3、AgNO3 |
| D、FeCl3、NaOH |

