题目内容
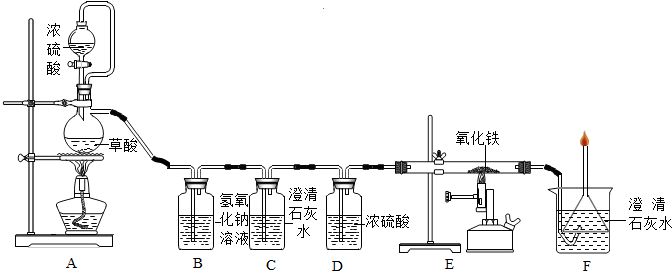
3.如图所示试剂瓶中分别盛有四种常见的化学药品.
(1)C 瓶中药品的化学式为CaCO3.D 瓶中药品的名称是氯化钠,D在生活中的一种用途是调味品.
(2)利用图所示的药品,按下列要求写出反应的化学方程式.
①实验室制取氧气:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
②选用一种药品与硫酸反应不生成气体:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
③选用一种药品与盐酸反应不生成气体:6HCl+Fe2O3═2FeCl3+3H2O.
分析 (1)根据物质的名称、化学式以及物质的用途来分析;
(2)利用图中所示的药品,按下列要求写出反应的化学方程式.
①实验室制取氧气:反应物为KMnO4,反应条件为加热,生成物为K2MnO4、MnO2、O2则可书写化学方程式;
②氧化铁与硫酸反应生成硫酸铁和水;
③氧化铁与稀盐酸反应生成氯化铁和水.
解答 解:(1)“某酸某”类化合物一般由金属和酸根组成,碳酸钙的化学式为:CaCO3;故答案为:CaCO3;
依据NaCl,物质的名称为:氯化钠;故答案为:氯化钠;
氯化钠在生活中是一种重要的调味品,故填:调味品;
(2)①实验室制取氧气:已知反应物、反应条件、生成物,则:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;故填:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
②氧化铁与硫酸反应生成硫酸铁和水,没有气体生成,故填:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
③氧化铁与稀盐酸反应生成氯化铁和水,没有气体生成,故填:6HCl+Fe2O3═2FeCl3+3H2O.
点评 在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.

练习册系列答案
相关题目
11.有以下事实:
①煤燃烧后质量变小;
②铁制品生锈后质量增加;
③石灰水放在敞口的容器里其质量增加;
④水结成冰体积变大.
其中符合质量守恒定律的是( )
①煤燃烧后质量变小;
②铁制品生锈后质量增加;
③石灰水放在敞口的容器里其质量增加;
④水结成冰体积变大.
其中符合质量守恒定律的是( )
| A. | ①③④ | B. | ①②④ | C. | ①②③ | D. | ①②③④ |


 ,氯原子的最外层电子数为7.下列图中微粒共表示三种元素,其中与氯原子具有相似化学性质的是D(填序号).
,氯原子的最外层电子数为7.下列图中微粒共表示三种元素,其中与氯原子具有相似化学性质的是D(填序号).
 ,则x的数值可能是下列中的CD.
,则x的数值可能是下列中的CD.