题目内容
锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为
- A.0.15g
- B.0.20g
- C.0.30g
- D.0.45g
A
分析:锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,生成硫酸锌、硫酸铝、硫酸镁混合物11g,根据反应前后元素质量不变,则硫酸锌、硫酸铝、硫酸镁三种物质的混合物中含硫酸根的质量为11g-3.8g=7.2g;根据硫酸中氢与硫酸根的比,计算出氢元素的质量,即产生氢气的质量.
解答:根据反应前后元素质量不变,反应生成的11g硫酸锌、硫酸铝、硫酸镁混合物中含有硫酸根的质量=11g-3.8g=7.2g;根据硫酸的化学式H2SO4,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含硫酸根的质量为7.2g时,硫酸中H元素的质量=7.2g×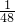 =0.15g,即反应中产生的氢气质量为0.15g;
=0.15g,即反应中产生的氢气质量为0.15g;
故选A.
点评:本题的解决技巧在于:由金属和硫酸根所组成的硫酸盐中,除去金属余下的就是硫酸根.
分析:锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,生成硫酸锌、硫酸铝、硫酸镁混合物11g,根据反应前后元素质量不变,则硫酸锌、硫酸铝、硫酸镁三种物质的混合物中含硫酸根的质量为11g-3.8g=7.2g;根据硫酸中氢与硫酸根的比,计算出氢元素的质量,即产生氢气的质量.
解答:根据反应前后元素质量不变,反应生成的11g硫酸锌、硫酸铝、硫酸镁混合物中含有硫酸根的质量=11g-3.8g=7.2g;根据硫酸的化学式H2SO4,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含硫酸根的质量为7.2g时,硫酸中H元素的质量=7.2g×
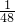 =0.15g,即反应中产生的氢气质量为0.15g;
=0.15g,即反应中产生的氢气质量为0.15g;故选A.
点评:本题的解决技巧在于:由金属和硫酸根所组成的硫酸盐中,除去金属余下的就是硫酸根.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目