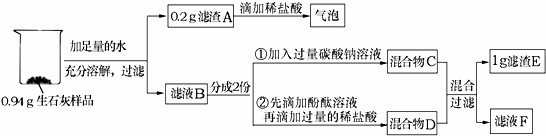
题目内容
下列化学方程式书写正确的 是
是
A.Fe2O3+2H2SO4═2FeSO4+2H2O B.2NaOH+K2CO3═2KOH+Na2CO3
C.2H2O2 2H2↑+O2
2H2↑+O2 ↑ D.Fe+2AgNO3═Fe(NO3)2+2Ag
↑ D.Fe+2AgNO3═Fe(NO3)2+2Ag
D

已知A、B、C、D、E五种物质之间存在以下转化关系。其中A、C两种物质的组成元素相同,且常温下是液体,E是天然气的主要成分。
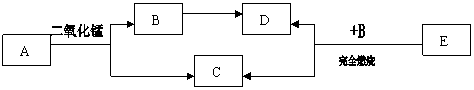 |
请回答:(1)写出DE两种物质的化学式:D ,E 。
(2)写出A→B+C的化学方程式:。
(3)写出D物质的一种用途: 。
依据国家相关法律规定,机动车驾驶员醉驾将受到刑事处罚。检测驾驶员是否酒后驾车,可用一种装有重铬酸钾(K2Cr2O7)的仪器。在K2Cr2O7中Cr元素的化合价是
A.+2 B.+3 C.+6 D.+7
要除去下列各组物质中的少量杂质,所选试剂和方法不可行的是
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | O2 | 水蒸气 | 通过浓H2SO4洗气 |
| B | MnO2 | 炭粉 | 在空气中灼烧 |
| C | KCl溶液 | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量铁屑,充分反应后过滤 |
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式_______________。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我_____(“同意”或“不同意”)小明的观点,因为___________。
 (3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 | 实验现象及结论 |
【反思与交流】空气中N2的含量计远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释_____________。
[注意:若答对第(3)小题奖励4分,化学试卷总分不超过60分。]
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2,实验现象如下:
| 实验序号 | 实验1 | 实验2 | 实验3 | |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4l | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后,实验现象 | 气泡明显增多可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
上表中,用水进行实验的目的是_________________。
根据上表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分):①__________;②_____________;③______________。
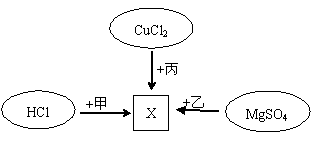
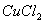 与物质丙反应的基本类型是_________;
与物质丙反应的基本类型是_________;