题目内容
请根据下列装置图回答问题.
(1)写出有标号仪器的名称:①
(2)装置B有明显错误,指出其中一处是 ,利用改正后的B和 (填字母)装置组合可用于实验室制取二氧化碳,相对于B,装置F具有的优点是 .若实验室用高锰酸钾制取氧气,反应的化学方程式是 ,可选用的发生装置是 (填字母).
(3)某品牌牙膏中磨擦剂的主要成分是碳酸钙,现通过如图实验装置测定碳酸钙的质量分数(假设样品中其他成分与盐酸不反应).

①装置A中发生反应的化学方程式是 .
②下列各项措施不能提高测定准确度的是 (填字母).
a.缓慢地滴加盐酸 b.在A、B之间增加装有浓硫酸的洗气瓶
c.将C中NaOH溶液换成Ca(OH)2溶液 d.在B装置反应结束后仍继续通入空气.

(1)写出有标号仪器的名称:①
(2)装置B有明显错误,指出其中一处是
(3)某品牌牙膏中磨擦剂的主要成分是碳酸钙,现通过如图实验装置测定碳酸钙的质量分数(假设样品中其他成分与盐酸不反应).

①装置A中发生反应的化学方程式是
②下列各项措施不能提高测定准确度的是
a.缓慢地滴加盐酸 b.在A、B之间增加装有浓硫酸的洗气瓶
c.将C中NaOH溶液换成Ca(OH)2溶液 d.在B装置反应结束后仍继续通入空气.
考点:常用气体的发生装置和收集装置与选取方法,实验探究物质的组成成分以及含量,气体的净化(除杂),实验室制取氧气的反应原理,二氧化碳的实验室制法,盐的化学性质
专题:常见气体的实验室制法、检验、干燥与净化,科学探究
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)如果装置连接不正确,会影响实验结果,甚至会导致实验失败;
不同的实验装置,功能不同;
高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气;
(3)氢氧化钠能够吸收二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
缓慢地滴加盐酸有利于减少氯化氢的挥发;
在B装置反应结束后仍继续通入空气有利于使反应产生的二氧化碳全部被氢氧化钠溶液吸收.
(2)如果装置连接不正确,会影响实验结果,甚至会导致实验失败;
不同的实验装置,功能不同;
高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气;
(3)氢氧化钠能够吸收二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
缓慢地滴加盐酸有利于减少氯化氢的挥发;
在B装置反应结束后仍继续通入空气有利于使反应产生的二氧化碳全部被氢氧化钠溶液吸收.
解答:解:(1)①是酒精灯,常用作热源.
故填:酒精灯.
(2)装置B中的明显错误有:长颈漏斗下端没有伸入液面,生成的气体会从长颈漏斗逸出;
导管伸入液体中,产生的气体无法导出;
利用改正后的B和D装置组合可用于实验室制取二氧化碳;
相对于B,装置F具有的优点是能够随时控制反应的发生和停止;
若实验室用高锰酸钾制取氧气,反应的化学方程式是:2KMnO4
K2MnO4+MnO2+O2↑,反应需要加热,应该用A装置作为发生装置.
故填:长颈漏斗下端没有伸入液面以下或导管伸入液体中;D;能够随时控制反应的发生和停止;
2KMnO4
K2MnO4+MnO2+O2↑;A.
(3)①装置A中发生反应的化学方程式是:2NaOH+CO2=Na2CO3+H2O.
故填:2NaOH+CO2=Na2CO3+H2O.
②a.缓慢地滴加盐酸,有利于减少氯化氢的挥发,能提高测定准确度;
b.在A、B之间增加装有浓硫酸的洗气瓶,干燥后的气体从B装置导出后仍然带出水蒸气,不能提高测定准确度;
c.将C中NaOH溶液换成Ca(OH)2溶液时,不利于吸收二氧化碳,不能提高测定准确度;
d.在B装置反应结束后仍继续通入空气,有利于使产生的二氧化碳全部被氢氧化钠溶液吸收,能提高测定准确度.
故填:bc.
故填:酒精灯.
(2)装置B中的明显错误有:长颈漏斗下端没有伸入液面,生成的气体会从长颈漏斗逸出;
导管伸入液体中,产生的气体无法导出;
利用改正后的B和D装置组合可用于实验室制取二氧化碳;
相对于B,装置F具有的优点是能够随时控制反应的发生和停止;
若实验室用高锰酸钾制取氧气,反应的化学方程式是:2KMnO4
| ||
故填:长颈漏斗下端没有伸入液面以下或导管伸入液体中;D;能够随时控制反应的发生和停止;
2KMnO4
| ||
(3)①装置A中发生反应的化学方程式是:2NaOH+CO2=Na2CO3+H2O.
故填:2NaOH+CO2=Na2CO3+H2O.
②a.缓慢地滴加盐酸,有利于减少氯化氢的挥发,能提高测定准确度;
b.在A、B之间增加装有浓硫酸的洗气瓶,干燥后的气体从B装置导出后仍然带出水蒸气,不能提高测定准确度;
c.将C中NaOH溶液换成Ca(OH)2溶液时,不利于吸收二氧化碳,不能提高测定准确度;
d.在B装置反应结束后仍继续通入空气,有利于使产生的二氧化碳全部被氢氧化钠溶液吸收,能提高测定准确度.
故填:bc.
点评:实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列图象能正确反映溶液质量随着反应时间的变化关系的是( )
A、 是向硫酸铜溶液中加入锌粒 |
B、 是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 |
C、 是向一定质量的稀硫酸中加入锌粒 |
D、 是向饱各硝酸钾溶液中加入硝酸钾固体 |

 3月22日是“世界水日”,化学课上,张老师列举出《你们都来污染我》的图片,引起全班同学的深思,保护水资源、节约用水人人有责.身为环保小卫士,你将向环保部门提出哪些建议?(写出三点)
3月22日是“世界水日”,化学课上,张老师列举出《你们都来污染我》的图片,引起全班同学的深思,保护水资源、节约用水人人有责.身为环保小卫士,你将向环保部门提出哪些建议?(写出三点) 化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究: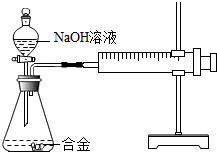 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动. 下列物质为初中化学常见物质,请根据叙述回答问题:
下列物质为初中化学常见物质,请根据叙述回答问题: 氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答:
氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答: