题目内容
5.小明在实验室里将氢氧化钠溶液和盐酸混合,无明显现象.【提出问题】两者是否发生了化学反应?
【猜想与假设】猜想①:发生了化学反应;猜想②:没有发生化学反应
【实验探究】
(1)甲同学取2mLNaOH溶液于试管中,滴人1~2滴酚酞试剂,振荡,逐滴加入稀盐酸,同时不断振荡试管,观察到的现象是溶液由无色变为红色又由红色变为无色,上述实验现象证明:随着稀盐酸的滴人,溶液碱性减弱,这是由于氢氧化钠与盐酸发生了反应被消耗,由此证明,上述实验过程确实发生了化学反应.请写出该反应的化学方程式HCl+NaOH=NaCl+H2O.
(2)老师将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度、pH进行实时测定,得到的曲线如图所示.

乙同学认为根据图象也能判断出稀盐酸与稀氢氧化钠溶液发生了反应,乙同学的依据是一段时间内溶液的温度升高,而溶液pH明显下降直至7以下;请你根据图中曲线判断大约50秒时二者恰好发生反应.
【实验反思】
丙同学认为溶液温度升高也可能是氢氧化钠溶液或盐酸稀释释放的热量,不足以证明二者发生了反应,请设计合理的实验方案排除这种可能性.
【实验拓展】
对于没有明显现象的化学变化,可以通过验证反应物消失、新物质生成、监测温度、pH变化等来“造出现象”,使反应现象明显,从而获得正确的认识.
请再设计出一种不同的实验方案证明氢氧化钠溶液与稀盐酸确实发生反生了化学反应.
分析 【实验探究】
(1)根据氢氧化钠与盐酸的反应、溶液的酸碱性的变化分析回答有关的问题;
(2)根据溶液温度的变化、酸碱度的变化分析回答;
【实验反思】
利用对比试验探究溶液的酸碱中反应是放热反应;
【实验拓展】
根据酸碱的性质分析设计实验方案证明氢氧化钠溶液与稀盐酸确实发生反生了化学反应.
解答 解:【实验探究】
(1)氢氧化钠溶液能够使酚酞变红,所以将酚酞滴入氢氧化钠溶液中后会观察到溶液变红,而酚酞在中性和酸性溶液中呈无色,所以当向滴加了酚酞的氢氧化钠溶液中滴加盐酸会发现溶液的红色逐渐减弱,最终会变成无色;通过观察实验过程可以知道,随着盐酸的滴入,溶液碱性逐渐减弱.这是由于盐酸和氢氧化钠溶液发生了中和反应,反应的化学方程式为:HCl+NaOH=NaCl+H2O.
(2)由图象可见随着盐酸的滴入,一段时间内溶液的温度升高,溶液pH明显下降直至7以下,说明氢氧化钠溶液和盐酸发生了化学反应,且该反应是个放热反应.据图可知,当溶液pH=7和温度达最高值时,对应的时间大约为50秒.
【实验反思】
分别用水稀释原氢氧化钠溶液和盐酸,用温度传感器监测温度变化.可分别排除氢氧化钠溶液和盐酸稀释放热的可能.使原实验更具说服力.
【实验拓展】
氢氧化钠具有碱性,会与硫酸铜反应生成氢氧化铜沉淀,所以可以加入硫酸铜,无蓝色沉淀说明溶液中无氢氧化钠存在,即可说明二者发生了反应.盐酸具有酸性可以和氢前金属、碳酸盐等反应产气,在氢氧化钠溶液中加入铁钉,开始加入稀盐酸不产气,说明盐酸与氢氧化钠反应被消耗,说明二者发生了反应.所以实验方案是:
方案一:向氢氧化钠溶液中加入过量的稀盐酸,然后加入硫酸铜,无蓝色沉淀生成,说明氢氧化钠被盐酸消耗.证明二者发生了化学反应.
方案二:向适量氢氧化钠溶液中加入一根打磨过的铁钉,无气泡产生,再逐滴加入稀盐酸,一段时间后才有气泡产生,说明开始滴入的盐酸被氢氧化钠消耗等.
故答为:【实验探究】
(1)溶液由无色变为红色又由红色变为无色;减弱; 氢氧化钠与盐酸发生了反应被消耗;HCl+NaOH=NaCl+H2O.
(2)一段时间内溶液的温度升高,而溶液pH明显下降直至7以下;填45~55都对
【实验反思】分别用等量的水替代盐酸和氢氧化钠溶液,稀释原氢氧化钠溶液和盐酸,用温度传感器监测温度变化.温度无明显变化,则说明溶液温度升高是二者反应产生的.
【实验拓展】(答案开放,合理即可)
方案一:向氢氧化钠溶液中加入过量的稀盐酸,然后加入硫酸铜,无蓝色沉淀生成,说明氢氧化钠被盐酸消耗.证明二者发生了化学反应.
方案二:向适量氢氧化钠溶液中加入一根打磨过的铁钉,无气泡产生,再逐滴加入稀盐酸,一段时间后才有气泡产生,说明开始滴入的盐酸被氢氧化钠消耗.
点评 本题主要考查实验设及分析计能力、转化的思想、酸和碱的化学性质、中和反应及化学方程式书写等知识.

| A. | 冰、干冰、赤铁矿 | B. | 氢气、生石灰、煤 | ||
| C. | 红磷、纯碱、石油 | D. | 金刚石、熟石灰、空气 |
| A. | Ag | B. | Cu | C. | Zn | D. | Mg |
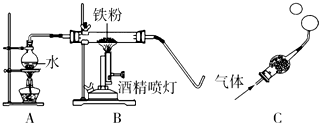
(1)A装置的作用是 ①提供水蒸气.
(2)探究生成的气体是什么?
【猜想与假设】猜想一:生成的气体可能是氢气;猜想二:生成的气体可能是氧气.
【实验探究】将生成的气体通入球形管里装有碱石灰干燥剂.导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡.当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
【推断】生成的气体是②氢气.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
【猜想与假设】猜想一:剩余固体是Fe和Fe3O4;猜想二:剩余固体是 ③Fe3O4.
【实验探究】
| 实验操作 | 实验现象及结论 |
| ④取少量黑色固体于试管中,加入足量的稀盐酸 | ⑤若固体全部溶解,没有气泡冒出,则猜想二正确;若固体全部溶解,有气泡冒出,则猜想一正确 |
【反思与交流】该黑色固体不可能是FeO、Fe2O3,理由是 ⑦FeO不能被磁铁吸引,Fe2O3红棕色粉末且不能被磁铁吸引.
【提出问题】生成物中有哪几种碳的氧化物?
【猜测】
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | 含有CO和CO2 |

【实验探究】
(1)观察到装置A(填序号)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成.
(2)有两种实验现象都能分别证明草酸分解的气体中含有CO:
①C装置中澄清石灰水不变浑浊,F装置中澄清石灰水变浑浊;
②E装置中出现黑色粉末变成红色的现象.
【实验结论】通过实验探究证明:猜测3成立.
草酸分解的化学方程式是H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O.
【问题讨论】
(1)B装置的作用是除去气体中的二氧化碳,避免对气体中一氧化碳的检验造成干扰,;D装置的作用是除去混合气中的水蒸气.
(2)装置末端酒精灯的作用是点燃尾气中一氧化碳,防止污染空气.
【提出问题】氧化铜与木炭充分反应结束后,试管中的黑色固体是什么?
【猜想假设】黑色固体可能是①木炭②氧化铜③木炭、氧化铜
【查阅资料】木炭不与稀硫酸反应;
【实验验证】取少量该黑色固体在空气中灼烧,观察现象.如果猜想①正确,现象应该是黑色粉末逐渐减少直至消失;
【实验设计】请你再设计一种方法来证明猜想②或③正确;(请简明写出操作、步骤和结论)
| 实验操作 | 实验现象 | 实验结论 |
 固体A、B的溶解度曲线如图所示.
固体A、B的溶解度曲线如图所示.