题目内容
根据下列实验装置图,回答问题:
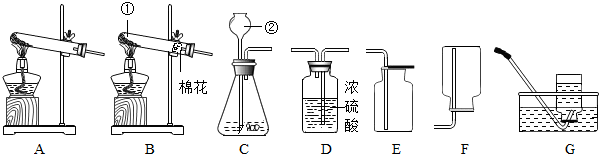
(1)写出标有序号的仪器的名称
① ②
用C、E组合可以制取一种气体,其反应化学方程式是 ;
还可以制取 (填化学式),可用 或 装置收集(填字母)
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式 .并据此选择上图中 (填字母)组装一套制取干燥氧气的装置,收集氧气时,验满的方法是 .
(3)小明同学在使用“除垢净”去除热水瓶中的水垢时,发现有大量的气泡产生.联想水垢的主要成分是碳酸钙,小明猜想“除垢净”的成分中可能有酸.
①为证实自己的猜想,小明从家中又找来两类不同的物质进行实验.
实验一:
实验二:
经试验,小明得出“除垢净”的有效成分中一定有酸的结论.
②小明想利用盐酸、硫酸自制一瓶“除垢净”,那么 最合适,理由是
③在使用“除垢净”时应注意 .

(1)写出标有序号的仪器的名称
①
用C、E组合可以制取一种气体,其反应化学方程式是
还可以制取
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式
(3)小明同学在使用“除垢净”去除热水瓶中的水垢时,发现有大量的气泡产生.联想水垢的主要成分是碳酸钙,小明猜想“除垢净”的成分中可能有酸.
①为证实自己的猜想,小明从家中又找来两类不同的物质进行实验.
实验一:
实验二:
经试验,小明得出“除垢净”的有效成分中一定有酸的结论.
②小明想利用盐酸、硫酸自制一瓶“除垢净”,那么
③在使用“除垢净”时应注意
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,氧气的检验和验满,二氧化碳的实验室制法,酸的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的酸 酸的通性,常见气体的实验室制法、检验、干燥与净化
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大;
通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
氧气的密度比空气的密度大,不易溶于水;
(2)浓硫酸具有吸水性,可以用作某些物质的干燥剂;
氧气能够支持燃烧,能使带火星的木条复燃;
(3)铁比较活泼,能和显酸性的物质反应生成盐和氢气;
纯碱属于碳酸盐,能和显酸性的物质反应生成盐、水和二氧化碳;
硫酸和碳酸钙反应生成的硫酸钙微溶于水;
因为除垢净中含有酸性物质,使用时要注意不能滴在比较活泼的金属器皿上,也不能滴在大理石地面上.
实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大;
通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
氧气的密度比空气的密度大,不易溶于水;
(2)浓硫酸具有吸水性,可以用作某些物质的干燥剂;
氧气能够支持燃烧,能使带火星的木条复燃;
(3)铁比较活泼,能和显酸性的物质反应生成盐和氢气;
纯碱属于碳酸盐,能和显酸性的物质反应生成盐、水和二氧化碳;
硫酸和碳酸钙反应生成的硫酸钙微溶于水;
因为除垢净中含有酸性物质,使用时要注意不能滴在比较活泼的金属器皿上,也不能滴在大理石地面上.
解答:解:(1)①是试管,常用作反应容器; ②是长颈漏斗,通过长颈漏斗可以向锥形瓶中注入液体药品;
用C、E组合可以制取二氧化碳,其反应化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
还可以制取氧气,氧气的化学式是O2;
因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,即用G装置收集.
故填:试管;长颈漏斗; CaCO3+2HCl═CaCl2+H2O+CO2↑;O2;E;G.
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为:2H2O2
2H2O+O2↑;
实验室用过氧化氢溶液和二氧化锰制取氧气不需要加热,应该用C装置作为发生装置,通过D装置中的浓硫酸可以干燥氧气,利用E装置可以收集到干燥的氧气;
收集氧气时,验满的方法是:把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满.
故填:2H2O2
2H2O+O2↑;CDE;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满.
(3)①实验一:把铁丝伸入除垢净中,有大量气泡产生;
实验二:把适量的纯碱放入除垢净中,有大量气泡产生.
故填:把铁丝伸入除垢净中,有大量气泡产生;把适量的纯碱放入除垢净中,有大量气泡产生.
②盐酸最合适,理由是:硫酸和碳酸钙反应生成的硫酸钙微溶于水,包裹在碳酸钙的表面,阻止反应的进行;而盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,能使反应顺利进行.
故填:盐酸;硫酸和碳酸钙反应生成的硫酸钙微溶于水,包裹在碳酸钙的表面,阻止反应的进行;而盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,能使反应顺利进行.
③在使用“除垢净”时应注意:不要把除垢净滴在金属器皿、大理石地面上.
故填:不要把除垢净滴在金属器皿、大理石地面上.
用C、E组合可以制取二氧化碳,其反应化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
还可以制取氧气,氧气的化学式是O2;
因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,即用G装置收集.
故填:试管;长颈漏斗; CaCO3+2HCl═CaCl2+H2O+CO2↑;O2;E;G.
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为:2H2O2
| ||
实验室用过氧化氢溶液和二氧化锰制取氧气不需要加热,应该用C装置作为发生装置,通过D装置中的浓硫酸可以干燥氧气,利用E装置可以收集到干燥的氧气;
收集氧气时,验满的方法是:把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满.
故填:2H2O2
| ||
(3)①实验一:把铁丝伸入除垢净中,有大量气泡产生;
实验二:把适量的纯碱放入除垢净中,有大量气泡产生.
故填:把铁丝伸入除垢净中,有大量气泡产生;把适量的纯碱放入除垢净中,有大量气泡产生.
②盐酸最合适,理由是:硫酸和碳酸钙反应生成的硫酸钙微溶于水,包裹在碳酸钙的表面,阻止反应的进行;而盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,能使反应顺利进行.
故填:盐酸;硫酸和碳酸钙反应生成的硫酸钙微溶于水,包裹在碳酸钙的表面,阻止反应的进行;而盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,能使反应顺利进行.
③在使用“除垢净”时应注意:不要把除垢净滴在金属器皿、大理石地面上.
故填:不要把除垢净滴在金属器皿、大理石地面上.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (1)写出图中标有字母的仪器的名称:a
(1)写出图中标有字母的仪器的名称:a (1)某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则x为
(1)某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则x为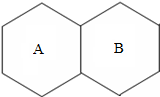 现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)
现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)