题目内容
6.下列各组物质能在pH=3的溶液中大量共存,且得到无色透明溶液的是( )| A. | Zn(NO3)2、MgSO4、NaCl、KNO3 | B. | Cu(NO3)2、NaCl、H2SO4、KNO3 | ||
| C. | Na2CO3、NaCl、KNO3、NH4Cl | D. | BaCl2、NaNO3、KOH、MgCl2 |
分析 在PH=3的溶液中存在大量的氢离子;物质在溶液中能共存时,物质在水中电离产生的离子不能结合生成气体、水、沉淀,且形成无色溶液时应注意常见离子在水溶液中的颜色.
解答 解:A、四种物质之间以及和氢离子都不会反应,可以共存,故选项正确;
B、铜离子在溶液中显蓝色,而本题中的溶液要求无色透明,故选项错误;
C、碳酸根离子会与氢离子生成二氧化碳气体不能共存,故选项错误;
D、氢氧根离子会与氢离子生成水,不能共存,故选项错误;
故选A.
点评 在解此类题时,根据选项中的离子之间只要会生成水、沉淀、气体中的一种,就不能共存,还要注意带色离子的记忆.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
7.下列有关氧气的叙述正确的是( )
| A. | 水中的生物能生存,是因为氧气极易溶于水 | |
| B. |  空气中氧气含量的测定实验(如图)中,可以将红磷换成木炭 | |
| C. | 用含有氧元素的物质反应才有可能产生氧气 | |
| D. | 氧气的化学性质非常活泼,是可燃物 |
18.实验室里有一瓶长期暴露在空气中的氢氧化钠固体,某化学兴趣小组对其进行了如下探究.
(1)确定固体的成分.
【提出猜想】
猜想Ⅰ:固体中只含碳酸钠; 猜想Ⅱ:固体中只含氢氧化钠;
猜想Ⅲ:固体中含有碳酸钠和氢氧化钠.
【进行实验】
(2)测定固体中碳酸钠的质量分数.
【查阅资料】二氧化碳几乎不溶于饱和碳酸氢钠溶液中.
【进行实验】取2g固体,在25℃、101kPa下用图1所示装置进行实验,步骤如下:
①连接好装置并检查气密性;
②装入药品,通过分液漏斗滴加足量稀硫酸后,关闭分液漏斗活塞;③充分反应后,恢复至25℃、101kPa,量筒中液体的体积为220mL.
【实验分析】
①装置B中的饱和碳酸氢钠溶液不能用水代替,原因是二氧化碳能够溶于水.
②充分反应后,装置A中残留的二氧化碳对实验结果是否有明显影响?没有(选填“有”或“没有”).
③已知在25℃、101kPa下二氧化碳的密度为1.8g/L,则固体中碳酸钠的质量分数为47.7%(结果保留至0.1%).
(3)除去固体中的碳酸钠.
【进行实验】实验流程如图2:

【实验分析】该流程中发生反应的化学方程式为CO3+Ba(OH)2═BaCO3↓+2NaOH.操作①、②、③均需用到的一种仪器是玻璃棒.
(1)确定固体的成分.
【提出猜想】
猜想Ⅰ:固体中只含碳酸钠; 猜想Ⅱ:固体中只含氢氧化钠;
猜想Ⅲ:固体中含有碳酸钠和氢氧化钠.
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量固体溶于水,加入过量的氯化钡溶液; | 产生白色沉淀 | 猜想Ⅲ成立 |
| ②将上述反应后的混合液过滤,取少量滤液,加入无色酚酞试液. | 酚酞试液变红色 |
【查阅资料】二氧化碳几乎不溶于饱和碳酸氢钠溶液中.
【进行实验】取2g固体,在25℃、101kPa下用图1所示装置进行实验,步骤如下:
①连接好装置并检查气密性;
②装入药品,通过分液漏斗滴加足量稀硫酸后,关闭分液漏斗活塞;③充分反应后,恢复至25℃、101kPa,量筒中液体的体积为220mL.
【实验分析】
①装置B中的饱和碳酸氢钠溶液不能用水代替,原因是二氧化碳能够溶于水.
②充分反应后,装置A中残留的二氧化碳对实验结果是否有明显影响?没有(选填“有”或“没有”).
③已知在25℃、101kPa下二氧化碳的密度为1.8g/L,则固体中碳酸钠的质量分数为47.7%(结果保留至0.1%).
(3)除去固体中的碳酸钠.
【进行实验】实验流程如图2:

【实验分析】该流程中发生反应的化学方程式为CO3+Ba(OH)2═BaCO3↓+2NaOH.操作①、②、③均需用到的一种仪器是玻璃棒.
15.“三效催化转换器”可以将汽车尾气中有毒气体处理为无毒气体.如图为该反应的微观示意图,其中不同的球代表不同种原子.下列说法中正确的是( )
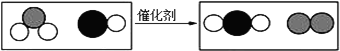

| A. | 分子在化学变化中不可分 | B. | 原子在化学变化中可分 | ||
| C. | 分子是由原子构成的 | D. | 原子比分子一定小 |
 如图是甲、乙、丙三种物质的溶解度曲线,甲与丙的溶解度曲线相交于P点.据图回答:
如图是甲、乙、丙三种物质的溶解度曲线,甲与丙的溶解度曲线相交于P点.据图回答: