��Ŀ����
3��������ͼ�ĸ���ѧʵ�飬�ش����⣺����ʾ��Cu��Zn�ĺϽ��Ϊ��ͭ��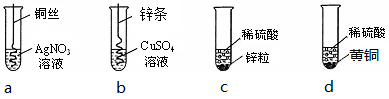
��1������ʵ��a�е�ʵ������ͭ˿���渽��һ������ɫ���壬��Һ����ɫ�����ɫ��
��2��Ҫ֤��Cu��Zn��Ag�Ļ��˳����Ҫ����ʵ����ab����ʵ����ţ���
��3����cʵ����ʣ����Һ�У�һ���е�����������п�������е����������ᣬΪ��ȷ�������е����ʣ��ɼ��������ѡ����ţ�
���Ȼ�����Һ��������ͭ������������Һ����п��
��4��Ϊ�˲ⶨd��ϡ�������������������ȡ20g�û�ͭ��Ʒ���ձ��У������з�4�μ����ϡ���ᣬ��ַ�Ӧ��ÿ������ϡ�����������ʣ������������¼���±���
| ����ϡ�����������g�� | ��ַ�Ӧ��ʣ������������g�� | |
| ��1�� | 25 | 16.75 |
| ��2�� | 25 | 13.5 |
| ��3�� | 25 | m |
| ��4�� | 25 | 12.0 |
������������m��ֵΪ12.0��
��ϡ������������������Ƕ��٣�19.6%�����ݻ�ѧ����ʽ���㣩
���� п��ͭ���ã�ͭ�������ã�
п��ϡ���ᷴӦ��������п�����������ݷ�Ӧ�Ļ�ѧ����ʽ�����ṩ�����ݿ��Խ�����ط���ļ�����жϣ�
��� �⣺��1��ʵ��a�У�ͭ����������Ӧ��������ͭ������ʵ��������ͭ˿���渽��һ������ɫ���壬��Һ����ɫ�����ɫ��
���ͭ˿���渽��һ������ɫ���壬��Һ����ɫ�����ɫ��
��2��a��ͭ����������Ӧ��������ͭ������˵��ͭ�������ã�b��п���渽��һ���ɫ���壬˵��п��ͭ���ã�Ҫ֤��Cu��Zn��Ag�Ļ��˳����Ҫ����ʵ����ab��
���ab��
��3����cʵ����ʣ����Һ�У�һ���е������Ƿ�Ӧ���ɵ�����п�������е������ǹ��������
ϡ�����ܺ�������ͭ��Ӧ��������ͭ��ˮ���ܺ�п��Ӧ��������п��������Ϊ��ȷ�������е����ʣ��ɼ���������ͭ��п����
���������������
��4�����ɵ�1�η�Ӧ��֪��25gϡ�����ܺ�3.25gп��Ӧ�����п��������3�η�Ӧ��ʣ���������Ӧ����10.25g������4��ʣ�����������12.0g��˵����3��ϡ����û����ȫ��Ӧ��ʣ�����������12.0g�����m=12.0��
���12.0��
��1�η�Ӧ��3.25gп��25gϡ������ȫ��Ӧ����25gϡ��������������Ϊx��
Zn+H2SO4�TZnSO4+H2����
65 98
3.25g x
$\frac{65}{3.25g}$=$\frac{98}{x}$��
x=4.9g��
��ϡ������������������ǣ�$\frac{4.9g}{25g}$��100%=19.6%��
���19.6%��
���� ������Ҫ����ѧ�����ü��跨�ͻ�ѧ����ʽ���м�����ƶϵ�����������ʱҪע��淶�Ժ�ȷ�ԣ�

| A�� | ��һ������ˮ | B�� | ������������ؾ��� | ||
| C�� | �����¶� | D�� | ����ʱ����������ˮ |
 |  |  |  |
| A����һ����ϡ�� ���м�ˮϡ�� | B��һ���¶��£������������Һ�м�������� | C������һ������ ������ع��� | D������������Ƭ����Ƭ�ֱ�������������������ͬ��ϡ���ᷴӦ |
| A�� | A | B�� | B | C�� | C | D�� | D |
| ���� | ���� | ���� |
| ��ȼ�ŵ�ľ���ֱ������ĸ�����ƿ�У��ٽ������ʯ��ˮ�ֱ���ʹľ��Ϩ�����������ƿ�� | һ��ƿ��ȼ�ŵ�ľ��ȼ�ո�����һ��ƿ��ȼ�ŵ�ľ���ճ�ȼ�գ�����ƿ��ȼ�ŵ�ľ��Ϩ������Ϩ�������ƿ�м������ʯ��ˮʱ��һ��ƿ��ʯ��ˮ����ǣ�һ��ƿ��û������ | ʹľ��ȼ�ո�������������ʹľ��Ϩ����ǵ����������̼��������ǿ�������ʹ����ʯ��ˮ����ǵ��Ƕ�����̼��û�б仯���ǵ��� |
| A�� | ũ�ҷ��ϵĸ��� | B�� | ��ֲ��ĺ��� | C�� | �ƺʹ����� | D�� | ʯ�ҽ���Ӳ |

