题目内容
13. 20g硫酸镁溶液中混有少量硫酸,往该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9g氢氧化镁沉淀.沉淀的质量变化如图所示.
20g硫酸镁溶液中混有少量硫酸,往该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9g氢氧化镁沉淀.沉淀的质量变化如图所示.(1)求20g溶液中硫酸镁的质量分数.
【相关反应的化学方程式为MgSO4+2NaOH=Mg(OH)2↓+Na2SO4】
(2)氢氧化钠的质量≤ag时,反应不产生沉淀,其原因是氢氧化钠不足,由于硫酸的存在氢氧化钠与硫酸镁不能生成氢氧化镁沉淀.
分析 向硫酸和硫酸镁的混合溶液滴加氢氧化钠溶液,硫酸、硫酸镁都可与氢氧化钠发生反应,由于硫酸的存在氢氧化钠与硫酸镁不能生成氢氧化镁沉淀,待硫酸反应完才能产生氢氧化镁沉淀;所以图象记录数据中,加入不大于ag氢氧化钠溶液时产生沉淀的质量为0;而在加入氢氧化钠溶液不小于bg时,产生沉淀的质量均为2.9g,说明硫酸镁已完全反应,;根据硫酸镁与氢氧化钠反应的化学方程式,由沉淀氢氧化镁的质量可计算混合溶液中硫酸镁的质量从而可计算出硫酸镁的质量分数.
解答 解:(1)设20g溶液中硫酸镁的质量为x,
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 58
x 2.9g
$\frac{120}{58}$=$\frac{x}{2.9g}$
x=6g
20g溶液中硫酸镁的质量分数=$\frac{6g}{20g}$×100%=30%.
答:20g溶液中硫酸镁的质量分数为30%.
(2)结合图象可知,氢氧化钠的质量≤ag时,反应不产生沉淀,其原因是:氢氧化钠不足,由于硫酸的存在氢氧化钠与硫酸镁不能生成氢氧化镁沉淀.
故答案为:(1)30%;(2)≤a;氢氧化钠不足,由于硫酸的存在氢氧化钠与硫酸镁不能生成氢氧化镁沉淀.
点评 学生应熟悉利用化学方程式计算的思路和格式,能利用恰好反应及元素守恒和分析数据来解答.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
8.下列日常生活常见的金属中,金属活动性最强的是( )
| A. | Fe | B. | Cu | C. | Al | D. | Zn |
4.实验操作有误或不规范,很可能造成失败甚至酿成事故.下列实验操作正确的是( )
| A. |  存放氧气 | B. |  稀释浓硫酸 | ||
| C. |  测定空气里氧气含量 | D. |  检查装置气密性 |
1.推理是化学学习中常用的思维方法.下列推理正确的是( )
| A. | 酸和碱能发生中和反应,则硝酸与氢氧化钠也能发生中和反应 | |
| B. | 铝表面的氧化铝薄膜能起到保护作用,则铁表面的氧化铁也能起到保护作用 | |
| C. | 碱溶液能使石蕊试液变蓝,则能使石蕊试液变蓝的溶液一定是碱 | |
| D. | 蔗糖的饱和溶液,不能再溶解蔗糖,也一定不能再溶解其它物质 |
18.下列各种物质中,由分子构成的是( )
| A. | 铝 | B. | 金刚石 | C. | NaOH | D. | NH3 |
5.对下列日常生活中的现象解释不合理的是( )
| 生活中的现象 | 解释 | |
| A | 墙内开花墙外香 | 分子在不断运动 |
| B | 乙醇、油漆需要密闭保存 | 分子质量很小,故液体均易挥发 |
| C | 湿衣服在阳光下比阴凉处干得快 | 温度升高,分子运动速度加快 |
| D | 石油气加压可贮存在钢瓶中 | 分子间有间隔,加压使得间隔缩小 |
| A. | A | B. | B | C. | C | D. | D |
2.下列物质的用途与性质对应错误的是( )
| 物质 | 用途 | 性质 | |
| A | 二氧化碳 | 作气体肥料 | 二氧化碳既不燃烧也不支持燃烧 |
| B | 熟石灰 | 改良酸性土壤 | 熟石灰能与酸发生中和反应 |
| C | 氮气 | 用于食品防腐 | 氮气的化学性质较稳定 |
| D | 洗洁精 | 洗涤油污 | 洗洁精具有乳化作用 |
| A. | A | B. | B | C. | C | D. | D |
3.咸宁城际铁路的建成将进一步推动我市经济的发展,在修建铁路的土石方爆破中要用到黑火药,黑火药爆炸时发生反应的化学方程式是2KNO3+3C+S$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+X↑,根据以上信息,下列说法错误的是( )
| A. | X的化学式是N2 | B. | 黑火药在混合物 | ||
| C. | KNO3中氮元素的化合价为+5价 | D. | KNO3属于氨肥 |
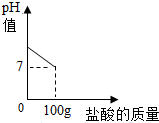 在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示:
在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示: