题目内容
9.为延缓袋装食品因缓慢氧化而变质,包装时不宜采用( )| A. | 充入氮气 | B. | 充入氧气 | C. | 充入二氧化碳 | D. | 真空包装 |
分析 食品变质的原因是食品跟空气中的水和氧气发生化学反应,所以为了延缓食品变质必须隔绝氧气和水分,据此进行分析判断.
解答 解:A、氮气化学性质不活泼,可用于食品防腐,可延缓食品变质,故可以采用.
B、充入氧气,会使食品发生缓慢氧化而变质,故不能采用.
C、二氧化碳学性质不活泼,可用于食品防腐,可延缓食品变质,故可以采用.
D、真空包装能隔绝氧气和水分,能延缓食品变质,故可以采用.
故选B.
点评 本题难度不大,物质的性质决定物质的用途,了解食品变质的原因、常见气体的性质是正确解答本题的关键.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
14. 如图是固体甲、乙两物质溶解度曲线图,下列说法正确的是( )
如图是固体甲、乙两物质溶解度曲线图,下列说法正确的是( )
 如图是固体甲、乙两物质溶解度曲线图,下列说法正确的是( )
如图是固体甲、乙两物质溶解度曲线图,下列说法正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 甲、乙两物质的溶解度都随温度升高而增大 | |
| C. | 将甲、乙两物质饱和溶液由50℃降到10℃时,所得两种溶液一定都是饱和溶液 | |
| D. | 20℃时,不可能配制质量分数为 30%的乙物质溶液 |
1.海水是巨大的资源宝库,利用海水为原料获得许多化工产品的流程如图:
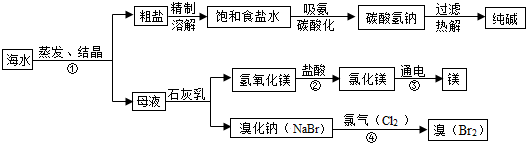
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、蒸发、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是因为氯化钠的溶解度受温度影响小.
(3)由上述流程图看出碳酸氢钠的热稳定性小于(填“大于、小于或等于)纯碱的热稳定性.
(4)步骤②发生的反应属于复分解反应(填一种基本反应类型).用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有质轻、强度大(任答一点).
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),反应后溴元素的化合价比反应前升高(填“升高”或“降低”或“不变”).
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
完成下列计算:
①固体样品中氯化钠的质量分数是15.2%;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)

(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、蒸发、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是因为氯化钠的溶解度受温度影响小.
(3)由上述流程图看出碳酸氢钠的热稳定性小于(填“大于、小于或等于)纯碱的热稳定性.
(4)步骤②发生的反应属于复分解反应(填一种基本反应类型).用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有质轻、强度大(任答一点).
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),反应后溴元素的化合价比反应前升高(填“升高”或“降低”或“不变”).
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
| 编 号 | 第 1 次 | 第 2次 | 第 3次 |
| 所取固体样品的质量/g | 13 | 10 | 10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g | 100 | 100 | 125 |
| 反应后生成沉淀的质量/g | 8 | 8 | 8 |
①固体样品中氯化钠的质量分数是15.2%;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)
18.下列反应的化学方程式及基本反应类型都正确的是( )
| A. | 用过氧化氢溶液和二氧化锰制氧气 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ 分解反应 | |
| B. | 用生石灰制熟石灰 CaO+H2O═Ca(OH)2 化合反应 | |
| C. | 用澄清石灰水鉴定CO2气体 CO2+Ca(OH)2═CaCO3↓+H2O 复分解反应 | |
| D. | 工业上用赤铁矿炼铁 3CO+Fe2O3$\frac{\underline{\;点燃\;}}{\;}$ 2Fe+3CO2 置换反应 |


