题目内容
7.以下是实验室常用的部分仪器.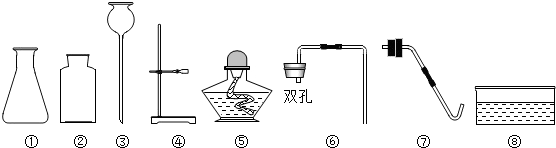
(1)仪器①的名称为锥形瓶;
(2)某同学要用过氧化氢溶液和二氧化锰混合制取氧气,已经选择了仪器①②③,则还需要从上图中选择的仪器是⑥(填仪器的序号),该方法制取氧气的优点是环保,无污染;
(3)此装置还可用于制取CO2气体,若制取8.8gCO2,理论上需要146g10%的稀盐酸与足量大理石反应.
分析 (1)熟记仪器的名称;
(2)过氧化氢溶液和二氧化锰混合制取氧气属于固液常温型,该同学选择了仪器①②③,有长颈漏斗,则须选择双孔塞;
(3)根据生成的二氧化碳的质量,由反应的化学方程式计算即可.
解答 解:(1)仪器①是锥形瓶;故填:锥形瓶;
(2)过氧化氢溶液和二氧化锰混合制取氧气属于固液常温型,该同学选择了仪器①②③,有长颈漏斗,则选择双孔塞,过氧化氢溶液和二氧化锰混合生成水和氧气,此方法环保,无污染;故填:⑥;环保,无污染;
(3)解:设需要10%的稀盐酸的质量为x,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
10%×x 8.8g
$\frac{73}{44}=\frac{10%×x}{8.8g}$
x=146g
故填:146.
点评 本题考查了仪器的名称、制取气体装置的选择以及根据化学方程式的计算,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目

 结合如图所示的实验装置,回答下列问题.
结合如图所示的实验装置,回答下列问题.
