题目内容
如图1所示,A、B、C为三种物质的溶解度曲线,请根据图示信息回答下列问题.
(1)t2℃时,A、B、C三种物质中溶解度最小的是 .
(2)t1℃时,将30gB物质投入100g水中,充分溶解,温度不变,所得溶液为 溶液(填“饱和”或“不饱和”).
(3)下列说法正确的是 .
A.t2℃时,将A和C的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有A和C
B.t2℃时,将A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数的大小关系是B>A>C
C.从混有少量B的A物质中提取较纯净的A,可通过冷却它们的热饱和溶液实现
D.t1℃时,欲用A的饱和溶液配制10%的A溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器
(4)如图2所示,向放有镁片的试管中滴加稀盐酸后,锥开瓶中C中的饱和溶液变浑浊.请解释原因 .

考点:
固体溶解度曲线及其作用;一定溶质质量分数的溶液的配制;结晶的原理、方法及其应用;晶体和结晶的概念与现象;物质发生化学变化时的能量变化.
专题:
溶液、浊液与溶解度.
分析:
(1)根据三种物质的溶解度曲线可以比较三种物质的溶解度的大小关系;
(2)根据t1℃时B的溶解度解答;
(3)根据A、B和C的溶解度曲线结合已有的知识进行解答;
(4)根据镁与盐酸反应放出热量解答.
解答:
解:(1)据图可以看出,t2℃时A、B、C三种物质中溶解度最小的是C,故填:C.
(2)t1℃时,B的溶解度是40g,将30gB物质投入100g水中,充分溶解,温度不变,所得溶液为不饱和溶液,故填:不饱和.
(3)A.t2℃时,将A和C的混合溶液(两者均已达到饱和),降温至t1℃,C的溶解度随温度的降低而减小,故C无晶体析出,错误;
B.由于在t2℃时,三物质的溶解度的大小关系为A>B>C,则其饱和溶液中溶质的质量分数的大小关系为A>B>C,将三种物质的饱和溶液将温到t1℃时,由于A和B的溶解度都随温度的降低而减小,它的溶液中就会有晶体析出,溶液中溶质的质量分数就会减小,但C的溶解度随温度的降低而增大,因此溶液中溶质的质量分数都不发生变化,但由图不难看出三物质的溶解度的大小关系为B>A>C,所得溶液中溶质质量分数的大小关系是B>A>C,正确;
C.A的溶解度受温度影响变化不大,从混有少量B的A物质中提取较纯净的A,可通过蒸发结晶的方法实现,错误;
D.t1℃时,欲用A的饱和溶液配制10%的A溶液,需要烧杯、量筒、胶头滴管、玻璃棒四种玻璃仪器,错误;
故填:B;
(4)向放有镁片的试管中滴加稀盐酸后,锥开瓶中C中的饱和溶液变浑浊,原因在于镁与盐酸反应放出了热量,温度升高,而C的溶解度随温度的升高而减小,故填:镁与盐酸反应放出热量导致温度升高,C的溶解度减小.
点评:
本题难度不是很大,主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线来解决相关的问题.

下列图象中有关量的变化趋势正确的是( )
|
| A. | 某温度下,向一定量不饱和硝酸钾溶液中不断加入硝酸钾晶体 |
|
| B. | 向一定量的稀盐酸中逐滴滴加水 |
|
| C. | 向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸 |
|
| D. | 将水通电电解一段时间 |
表是A物质在不同温度时的溶解度
| 温度/℃ | 0 | 20 | 40 | 60 |
| 溶解度/g | 17.5 | 20.0 | 24.2 | 28.0 |
(1)请在图中绘制A物质的溶解度曲线 ;
(2)当温度为 ℃时,A、B的溶解度相等;
(3)溶解度受温度变化影响较大的物质是 .
能用于治疗胃酸过多症的物质是( )
|
| A. | 蔗糖 | B. | 食盐 | C. | 小苏打 | D. | 食醋 |
下列实验方法一定能达到实验目的是( )
| 选项 | 实验目的 | 实验方法 |
| A | 检验一瓶气体是否为CO2 | 将燃着的木条伸入瓶中 |
| B | 鉴别H2和CH4 | 分别点燃,在火焰上方罩一干冷烧杯 |
| C | 鉴别石灰水和NaOH溶液 | 加入适量的稀盐酸 |
| D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入CuSO4溶液中 |
|
| A. | A | B. | B | C. | C | D. | D |
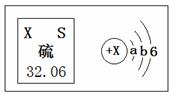 A、在硫原子的核外电子排布中a=2和b=8
A、在硫原子的核外电子排布中a=2和b=8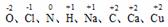
 B. HOOC﹣COOH C. HOCH2CH2OH D. CH3COOH
B. HOOC﹣COOH C. HOCH2CH2OH D. CH3COOH