题目内容
某同学对气体的实验室制法作了以下探究,请根据如图按要求回答问题:

(1)装置A中某种仪器的下端必须伸入到液体里,该仪器的名称是 .
(2)实验室用高锰酸钾制取O2的发生装置是 ,(所选装置用字母表示)某同学用排水法收集氧气,为了防止水槽内的水变成红色,其正确的操作是 .
(3)写出实验室用A装置制取氧气的化学方程式: .
(4)实验室若利用G装置收集CO2,则气体必须从 端通入.(用字母表示)

(1)装置A中某种仪器的下端必须伸入到液体里,该仪器的名称是
(2)实验室用高锰酸钾制取O2的发生装置是
(3)写出实验室用A装置制取氧气的化学方程式:
(4)实验室若利用G装置收集CO2,则气体必须从
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,制取氧气的操作步骤和注意点,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
(3)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
(4)二氧化碳的密度比空气的密度大.
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
(3)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
(4)二氧化碳的密度比空气的密度大.
解答:解:(1)装置A中的长颈漏斗下端必须伸入到液体里,这样可以防止生成的气体从长颈漏斗逸出.
故填:长颈漏斗.
(2)实验室用高锰酸钾制取氧气时需要加热,应该用B装置作为发生装置;
为了防止水槽内的水变成红色,应该在试管口塞一团棉花,以防高锰酸钾进入水槽中.
故填:B;在试管口放一团棉花.
(3)实验室用A装置制取氧气时不需要加热,应该是利用过氧化氢分解制取氧气,反应的化学方程式为:2H2O2
2H2O+O2↑.
故填:2H2O2
2H2O+O2↑.
(4)实验室若利用G装置收集CO2,由于二氧化碳的密度比空气大,则气体必须从a端通入.
故填:a.
故填:长颈漏斗.
(2)实验室用高锰酸钾制取氧气时需要加热,应该用B装置作为发生装置;
为了防止水槽内的水变成红色,应该在试管口塞一团棉花,以防高锰酸钾进入水槽中.
故填:B;在试管口放一团棉花.
(3)实验室用A装置制取氧气时不需要加热,应该是利用过氧化氢分解制取氧气,反应的化学方程式为:2H2O2
| ||
故填:2H2O2
| ||
(4)实验室若利用G装置收集CO2,由于二氧化碳的密度比空气大,则气体必须从a端通入.
故填:a.
点评:本题综合考查了学生的基本实验能力,涉及仪器的用途、化学方程式的书写、装置选择、实验基本操作等知识,只有综合理解化学知识才能够正确的解答.

练习册系列答案
相关题目
下列化肥中,不能跟碱性物质混用的是( )
| A、氯化钾 | B、尿素 |
| C、磷矿粉 | D、硝酸铵 |
下列化学用语表达不正确的是( )
| A、2C1--两个氯原子 |
| B、S2---负二价的硫元素 |
| C、2Fe2+--两个亚铁离子 |
| D、O2--氧气或一个氧分子 |
 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.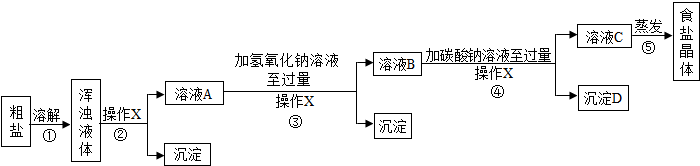

 把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是
把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是