题目内容
19.元素周期表是学习和研究化学的重要工具.下表是元素周期表中的一部分,请认真分析表中信息,回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(2)硫元素的原子结构示意图为
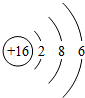 ,该元素的原子核外有3个电子层,其化学性质比较活泼,在化学反应中易得(填“得”、“失”)电子.
,该元素的原子核外有3个电子层,其化学性质比较活泼,在化学反应中易得(填“得”、“失”)电子.(3)由原子序数为13和17的两种元素组成的化合物是AlCl3(写化学式).
分析 (1)地壳中含量仅次于氧的非金属元素是硅元素,根据元素周期表中的一格可知,左上角的数字为原子序数,原子序数=核电荷数=质子数,据此进行分析解答.
(2)原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若原子的最外层电子数为8,则为稀有气体元素,属于相对稳定结构;若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
(3)原子序数为13和17的两种元素分别是铝元素和氯元素,写出其化合物的化学式即可.
解答 解:(1)地壳中含量仅次于氧的非金属元素是硅元素,其元素符号为:Si.根据硅元素周期表中的一格可知,左上角的数字为14,表示原子序数为14;根据原子序数=核电荷数=质子数,则该元素原子的质子数为14.
(2)硫元素的原子结构示意图为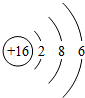 ,该元素的原子核外有3个电子层,最外层电子数是6,其化学性质比较活泼,在化学反应中易得到2个电子而形成阴离子.
,该元素的原子核外有3个电子层,最外层电子数是6,其化学性质比较活泼,在化学反应中易得到2个电子而形成阴离子.
(3)原子序数为13和17的两种元素分别是铝元素和氯元素,铝元素显+3价,氯元素显-1价,其化合物的化学式为:AlCl3.
故答案为:(1)Si;14;(2)3;得;(3)AlCl3.
点评 本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)、原子结构示意图的含义是正确解答本题的关键.

练习册系列答案
相关题目
10.为了探究影响金属与酸反应反应快慢的因素,进行以下实验:
由此得出影响金属与酸反应剧烈程度的因素有:
(1)金属活动性,活动性越强,反应速率越快.
(2)金属与酸的接触面,接触面越大,反应越快.
(3)酸的浓度,酸的浓度越大,反应越快(合理即可).
| 实验序号 | 实验过程 | 实验现象 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 |
| 2 | 铁粉和铁片分别与10%盐酸反应 | 铁粉产生气体快 |
| 3 | 铁片分别与5%盐酸和10%盐酸反应 | 10%盐酸产生气体快 |
(1)金属活动性,活动性越强,反应速率越快.
(2)金属与酸的接触面,接触面越大,反应越快.
(3)酸的浓度,酸的浓度越大,反应越快(合理即可).
7.下列对实验现象的描述正确的是( )
| A. | 向加碘食盐溶液中滴加淀粉,溶液不变色 | |
| B. | 铁在空气中燃烧,火星四射,生成黑色固体 | |
| C. | 向葡萄糖溶液中加入适量的新制Cu(OH)2并加热至沸,出现黑色固体 | |
| D. | 打开盛有浓盐酸的试剂瓶,瓶口会看到一团白烟 |
14.深圳市某中学科学兴趣小组,用自制的酸碱指示剂对KNO3、NaOH、HCl等溶液的酸碱性进行测定,结果记录如下
①经过探究,发现胡萝卜汁根本不宜作酸碱指示剂,这三种物质中理想的指示剂是牵牛花.
②小明是一个勤于思考,喜欢钻研的同学,发现了牵牛花瓣汁液遇NaOH溶液变蓝色后,思考到了一个问题,NaOH溶液中到底是哪种粒子使牵牛花汁液显蓝色呢?于是他和同学们继续探究.
【提出问题】NaOH溶液中何种粒子使牵牛花汁液发生颜色改变?
【提出猜想】
猜想1:使牵牛花汁液变色的粒子是H2O
猜想2:使牵牛花汁液变色的粒子是Na+
猜想3:使牵牛花汁液变色的粒子是OH-.
【设计实验】
| 植物的汁液 | 在HCl溶液中 | 在KNO3溶液中 | 在NaOH溶液中 |
| 牵牛花瓣 | 红色 | 紫色 | 蓝色 |
| 胡萝卜 | 橙色 | 橙色 | 橙色 |
| 月季花瓣 | 浅红色 | 红色 | 黄色 |
②小明是一个勤于思考,喜欢钻研的同学,发现了牵牛花瓣汁液遇NaOH溶液变蓝色后,思考到了一个问题,NaOH溶液中到底是哪种粒子使牵牛花汁液显蓝色呢?于是他和同学们继续探究.
【提出问题】NaOH溶液中何种粒子使牵牛花汁液发生颜色改变?
【提出猜想】
猜想1:使牵牛花汁液变色的粒子是H2O
猜想2:使牵牛花汁液变色的粒子是Na+
猜想3:使牵牛花汁液变色的粒子是OH-.
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 1、向盛有少量蒸馏水的试管里,滴加2滴牵牛花汁液,振荡; | 溶液呈紫色 | 使牵牛花汁液变色的不 是水分子. |
| 2、向盛有少量氯化钠溶液的试管里,滴加2滴牵牛花汁液,振荡; | 溶液呈紫色 | 使牵牛花汁液变色的不 是钠离子. |
| 3、向盛有少量氢氧化钙溶液的试管里滴加2滴牵牛花液汁,振荡. | 溶液呈蓝色 | 使牵牛花汁液变色的只能是 氢氧根离子. |
4.下列有关空气中某些成分的说法在,不正确的是( )
| A. | 氧气可用于医疗急救 | B. | 空气的主要成分是氮气和氧气 | ||
| C. | 新鲜空气中不含二氧化碳 | D. | 食品包装袋中充入氮气以防腐 |
11.氧化还原反应是高中将要学到的重要化学反应类型,已知有元素化合价升降的反应都属于氧化还原反应的,下列反应中不属于氧化还原反应的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | HCl+NaOH═NaCl+H2O | D. | 2H2S+SO2═3S↓+2H2O |
8.下列各种物质中,都是由离子构成的一组是( )
| A. | 铁和铜 | B. | 氯化钠和硫酸铜 | C. | 水和二氧化碳 | D. | 氧气和氢气 |
 如图是元素周期表中硫元素的信息示意图,其中的A表示原子序数;B表示元素名称.
如图是元素周期表中硫元素的信息示意图,其中的A表示原子序数;B表示元素名称.