题目内容
将一定量碳酸氢钠和铜的混合粉末放在容器里,在空气中用酒精灯加热至质量不再改变,发现加热前后固体总质量相等,写出有关的化学方程式,并计算原混合粉末中含铜的质量百分率.(碳酸氢钠加热会发生分解,生成碳酸钠、二氧化碳和水,计算结果精确到0.1%.)
【答案】分析:碳酸氢钠加热生成碳酸钠和水和二氧化碳;铜和氧气加热生成氧化铜.根据题目意思可知,二氧化碳和水的质量等于氧气的质量.
解答:解:设氧气的质量=二氧化碳和水的总质量=M克,设碳酸氢钠的质量是X,设铜的质量是Y.
2NaHCO3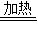 Na2CO3+H2O+CO2↑△M
Na2CO3+H2O+CO2↑△M
168 18 44 62
X M克
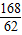 ═
═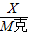
得:X=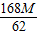 克
克
2Cu+O2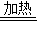 2CuO
2CuO
128 32
Y M克
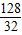 ═
═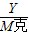
得:Y=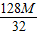 克
克
∴碳酸氢钠的质量=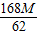 ═2.71M克,铜的质量=
═2.71M克,铜的质量=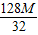 ═4M克.
═4M克.
∴原混合粉末的总质量=(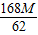 +
+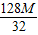 )=6.71M克.
)=6.71M克.
∴原混合粉末中铜的质量分数=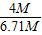 ×100%═59.6%.
×100%═59.6%.
答:原混合粉末中含铜的质量百分率为59.6%.
点评:掌握化学方程式的计算格式和规范性,本题的关键是知道二氧化碳和水的质量等于氧气的质量.
解答:解:设氧气的质量=二氧化碳和水的总质量=M克,设碳酸氢钠的质量是X,设铜的质量是Y.
2NaHCO3
 Na2CO3+H2O+CO2↑△M
Na2CO3+H2O+CO2↑△M168 18 44 62
X M克
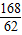 ═
═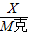
得:X=
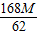 克
克2Cu+O2
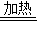 2CuO
2CuO128 32
Y M克
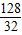 ═
═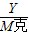
得:Y=
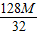 克
克∴碳酸氢钠的质量=
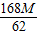 ═2.71M克,铜的质量=
═2.71M克,铜的质量=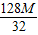 ═4M克.
═4M克.∴原混合粉末的总质量=(
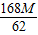 +
+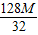 )=6.71M克.
)=6.71M克.∴原混合粉末中铜的质量分数=
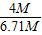 ×100%═59.6%.
×100%═59.6%.答:原混合粉末中含铜的质量百分率为59.6%.
点评:掌握化学方程式的计算格式和规范性,本题的关键是知道二氧化碳和水的质量等于氧气的质量.

练习册系列答案
相关题目