题目内容
9.如图中A、B、C、D是四种粒子的结构示意图,E是铁元素在周期表中的信息.
根据图中提供的信息,回答下列问题:
(1)图中A、B、C、D四种粒子共表示3种元素.
(2)在A、B、C、D中表示的阳离子与阴离子所形成的化合物的化学式为AlCl3.
(3)D中X═8.
(4)E中铁元素的一个铁原子质量是一个碳-12原子质量$\frac{1}{12}$的55.85倍.
分析 (1)不同种元素最本质的区别是质子数不同,据此进行分析解答.
(2)当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.
(3)原子中,核内质子数=核外电子数.
(4)根据元素周期表中的一个格能表示的信息、相对原子质量的含义分析回答.
解答 解:(1)根据不同种元素最本质的区别是质子数不同,图中共表示3种元素.
(2)A质子数=13,核外电子数=10,质子数>核外电子数,为铝离子;C质子数=17,核外电子数=18,质子数<核外电子数,为氯离子;所形成的化合物为氯化铝,其化学式为:AlCl3.
(3)原子中,核内质子数=核外电子数,18=2+8+x,x=8.
(4)E中铁元素的相对原子质量是55.85,由相对原子质量的含义可知,一个铁原子质量是一个碳-12原子质量$\frac{1}{12}$的55.85倍.
故答为::(1)3;(2)AlCl3;(3)8;(4)55.85.
点评 本题难度不大,了解原子结构示意图的意义、灵活运用元素周期表中元素的信息是正确解题的关键.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
20.食醋有酸味,是因为食醋中含有醋酸(化学式为CH3COOH),具有跟酸相似的化学性质.下列有关醋酸化学性质的叙述错误的是( )
| A. | 与金属铜反应,有氢气生成 | B. | 与铁锈反应,有水生成 | ||
| C. | 与烧碱反应,有水生成 | D. | 与鸡蛋壳反应,有气体生成 |
17.某兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了塞上瓶塞.这瓶溶液有没有变质呢?同学们想一探究竟,请你和他们一起参与.
【查阅资料】氯化钡溶液显中性,且氯化钡和碳酸钠能反应生成碳酸钡白色沉淀和氯化钠.
【提出猜想】假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质.
【实验验证】
【讨论交流】
(1)步骤①滴加过量的氯化钡溶液的目的是除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?不同意,因为加入氢氧化钡溶液引入了OH-,对检验氢氧化钠会造成干扰.
【反思】氢氧化钠敞口放置变质的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),因此氢氧化钠应密封保存.
【定量研究】相对原子质量:C-12 O-16 Na-23 Ca-40 Cl-35.5
从该瓶已部分变质为碳酸钠的氢氧化钠溶液中取出100.0g溶液,向其中加入100.0g氯化钙溶液,完全反应后过滤,测得滤液的质量为190.0g.
(计算结果精确到小数点后一位;有关化学方程式:Na2CO3+CaCl2=CaCO3+2NaCl)
(1)反应生成的沉淀质量是10g.
(2)所取的溶液中含碳酸钠的质量是多少克?
( 3)反应后滤液中氯化钠溶质的质量分数?
【查阅资料】氯化钡溶液显中性,且氯化钡和碳酸钠能反应生成碳酸钡白色沉淀和氯化钠.
【提出猜想】假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设一不成立 |
| ②静置,向上层清液中滴加酚酞溶液. | 溶液变红 | 假设二成立 |
(1)步骤①滴加过量的氯化钡溶液的目的是除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?不同意,因为加入氢氧化钡溶液引入了OH-,对检验氢氧化钠会造成干扰.
【反思】氢氧化钠敞口放置变质的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),因此氢氧化钠应密封保存.
【定量研究】相对原子质量:C-12 O-16 Na-23 Ca-40 Cl-35.5
从该瓶已部分变质为碳酸钠的氢氧化钠溶液中取出100.0g溶液,向其中加入100.0g氯化钙溶液,完全反应后过滤,测得滤液的质量为190.0g.
(计算结果精确到小数点后一位;有关化学方程式:Na2CO3+CaCl2=CaCO3+2NaCl)
(1)反应生成的沉淀质量是10g.
(2)所取的溶液中含碳酸钠的质量是多少克?
( 3)反应后滤液中氯化钠溶质的质量分数?
4.化学与我们的生活有着密切的关系.下列说法中正确的是( )
| A. | 发霉的黄豆洗干净后可制成豆油食用 | |
| B. | 少食蔬菜水果的同学会缺乏维生素C,可能患夜盲症 | |
| C. | 人体缺铁会引起贫血,因此应补充铁粉 | |
| D. | 青少年正处于生长发育期,应多食用含蛋白质丰富的食物 |
14.下列属于化石能源的是( )
| A. | 太阳能 | B. | 风能 | C. | 地热能 | D. | 煤炭 |
1.下列含氯元素的物质中,氯元素的化合价由低到高的一组是( )
| A. | Cl2、CaCl2、NaClO | B. | CaCl2、NaClO、Cl2 | C. | NaClO、Cl2、CaCl2 | D. | CaCl2、Cl2、NaClO |
18.下列变化属于化学变化的是( )
| A. | 铁锅生锈 | B. | 湿衣服晾干 | C. | 蜡烛熔化 | D. | 玻璃破碎 |
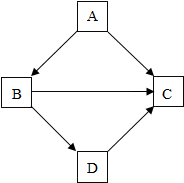 物质间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了如图框图.框图中“”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题:若A、B、C、D分别是Fe、Al、Mg、Cu四种金属的一种,则A的化学式为Mg,D的化学式为Fe.
物质间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了如图框图.框图中“”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题:若A、B、C、D分别是Fe、Al、Mg、Cu四种金属的一种,则A的化学式为Mg,D的化学式为Fe.