题目内容
1.用来测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.第一步:将集气瓶容积划分为五等份,并做好标记.
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的$\frac{1}{5}$.

请回答下列问题:
(1)写出一条集气瓶中剩余的气体的化学性质不燃烧、不支持燃烧,性质不活泼;
(2)已知某些非金属氧化物能和水反应生成酸,如:CO2+H2O═H2CO3,碳元素的化合价在反应前后不变.则红磷燃烧生成的白色固体溶于水后的化合物的化学式是H3PO4;
(3)实验完毕,若进入集气瓶中水的体积不到总容积的$\frac{1}{5}$,你认为导致这一结果的原因可是装置漏气(写出一点);
(4)某同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是防止五氧化二磷扩散到空气中污染环境,避免了红磷伸入集气瓶中时空气受热膨胀外逸,使结果更准确.
分析 (1)根据实验现象可以判断氮气的性质;
(2)根据题干信息来分析;
(3)如果操作不当,会影响实验结果,甚至会导致实验失败;
(4)不同的实验装置,优缺点不同.
解答 解:(1)集气瓶中剩余的气体主要是氮气;由红磷的熄灭,说明了氮气不燃烧、不支持燃烧,性质不活泼;由冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到一定高度不再上升.说明了氮气的溶解性是难溶于水.故填:不燃烧、不支持燃烧,性质不活泼;
(2)红磷燃烧的产物是五氧化二磷,其中磷元素显+5价,五氧化二磷与水反应生成的物质是磷酸,其中磷元素也显+5价,其化学式为H3PO4;故填:H3PO4;
(3)如果装置漏气,红磷不足,没有冷却至室温就打开弹簧夹,都能够导致实验完毕后,进入集气瓶中水的体积不到总容积的$\frac{1}{5}$;故填:装置漏气(答案合理即可);
(4)改进后的优点是:防止五氧化二磷扩散到空气中污染环境,避免了红磷伸入集气瓶中时空气受热膨胀外逸,使结果更准确.
故填:防止五氧化二磷扩散到空气中污染环境,避免了红磷伸入集气瓶中时空气受热膨胀外逸,使结果更准确.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
12.家用热水瓶常附有一层水垢(主要成分是CaCO3),要除去水垢,所采用的方法是( )
| A. | 用食用白醋洗涤 | B. | 用食盐水洗涤 | C. | 用洗洁精洗涤 | D. | 用肥皂水洗涤 |
16.科学家发现了两种新原子,它们的质子数都是117,中子数分别是117和118,下列有关叙述正确的是( )
| A. | 中子数为117的原子,相对原子质量为117 | |
| B. | 中子数为118的原子,核外有118个电子 | |
| C. | 这两种原子互为同位素原子 | |
| D. | 因为两种原子的质子数相同,所以两种原子的质量也相同 |
13.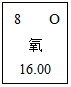 如图是元素周期表中氧元素的信息示意图,下列有关氧的说法错误的是( )
如图是元素周期表中氧元素的信息示意图,下列有关氧的说法错误的是( )
 如图是元素周期表中氧元素的信息示意图,下列有关氧的说法错误的是( )
如图是元素周期表中氧元素的信息示意图,下列有关氧的说法错误的是( )| A. | 氧是地壳中含量最高的非金属元素 | |
| B. | 氧原子的相对原子质量为16.00 | |
| C. | 氧原子的质子数为8 | |
| D. | 氧气在空气中所占的质量比约为21% |
10.如图是四位同学对某一个化学方程式意义的描述,他们描述的化学方程式是( )
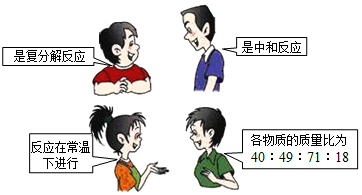

| A. | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | B. | Na2CO3+Ca(OH)2=CaCO3↓+2NaOH | ||
| C. | C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O | D. | 2NaOH+H2SO4=Na2SO4+2H2O |
11.La(镧)是一种活动性比锌强的金属,其氧化物为La2O3,对应的碱La(OH)3难深于水,而LaCl3、La(NO3)3都易溶液于水,下列各组物质中,不能直接反应制得LaCl3的是( )
| A. | La+HCl | B. | La2O3+HCl | C. | La(OH)3+CuCl2 | D. | La+ZnCl2 |
