题目内容
16.某化学实验室废液缸里的废液含有CuSO4、ZnSO4、FeSO4,将废液直接排放既造成浪费,又造成污染.小红利用课余时间进行废液处理,实验过程如下: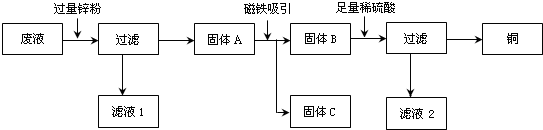
(1)用磁铁吸引的目的是将铁与锌、铜分离;滤液1和滤液2中含有一种相同的物质(水除外),该物质是ZnSO4.
(2)写出该流程中发生反应的化学方程式:
①加入过量锌粉后:Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe)(写出一个即可);
②加入足量稀硫酸后:Zn+H2SO4=ZnSO4+H2↑.
(3)若所加锌粉量不足,则滤液1中的物质(水除外)可能是AD(选填字母).
A.ZnSO4和FeSO4B.ZnSO4和CuSO4
C.CuSO4和FeSO4D.ZnSO4、CuSO4和FeSO4.
分析 (1)根据铜、锌、铁三种金属的活动性,判断向混合溶液中加入过量锌粉后所得固体的组成、滤液1和滤液2中含有一种相同的溶质.锌、铁、铜三种金属单质中,只有铁能被磁铁所吸起,因此使用磁铁吸引后,三种上金属分为两组,一组为铁粉另一组为铜粉和锌粉的混合物;
(2)根据流程中发生反应,写出反应的化学方程式;
(3)根据铜、锌、铁三种金属的活动性判断向混合溶液中加入锌粉后,当加锌粉量不足是,则滤液1中的可能含有的溶质.
解答 解:(1)向含有CuSO4、ZnSO4、FeSO4中加入过量的锌粉时,由于金属的活动性顺序是锌>铁>铜时,锌首先将铜从溶液中置换出来,再将铁置换出来,由于锌粉是过量的,所以过滤后,得到的固体A是Fe、Cu、Zn的混合物,滤液1中含有的溶质是ZnSO4.由于铁能被磁铁吸附,磁铁吸引的目的是将铁与锌、铜分离,再向混合物中加入足量的稀硫酸时,剩余的锌能与硫酸反应,铜不能与硫酸反应,过滤后溶液中含有ZnSO4,所以,滤液1和滤液2中含有一种相同的溶质,该溶质是ZnSO4;
(2)由上述的分析可知:①加入过量锌粉后,锌先后与硫酸铜、硫酸亚铁反应,反应的方程式是:Zn+CuSO4=ZnSO4+Cu,Zn+FeSO4=ZnSO4+Fe;
②加入足量稀硫酸后,剩余的锌与硫酸反应,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑;
(3)A、当加入的锌粉不足时,锌可能将铜恰好置换出来,这时溶液中的溶质是ZnSO4和FeSO4.故A正确;
B、由于铁的活泼性大于铜.锌应将铜置换出来后才能置换铁,所以溶液中的溶质是不可能是ZnSO4和CuSO4.故B不正确;
C、溶液中一定含有ZnSO4.故C不正确;
D、当加入的锌粉不足时,锌不将铜全部置换出来,这时溶液中的溶质是:ZnSO4、CuSO4和FeSO4.故D正确.
故答案为:
(1)将铁与锌、铜分离,ZnSO4;
(2)①Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe);
②Zn+H2SO4=ZnSO4+H2↑;
(3)AD.
点评 这是一道框图形推断题,解题关键是根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来这一理论.

 名校课堂系列答案
名校课堂系列答案
 某同学发现化肥袋上有一标签,如图所示:根据图示回答下列问题
某同学发现化肥袋上有一标签,如图所示:根据图示回答下列问题
