题目内容
7.归纳总结是学习科学的重要方法,刘星同学用图甲总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应).
(l)在图甲中,刘星同学还有一条关于NaOH的化学性质未总结,请你帮它在④(非金属氧化物)处总结好.
(2)为了验证反应①能够发生,刘星选择下列哪种物质D.
A.HNO3 B.NaCl C.Na2CO3 D.CuSO4.
分析 (1)根据碱的化学性质分析;
(2)根据复分解反应发生的条件分析.
解答 解:(1)氢氧化钠除了能够和酸碱指示剂、酸、某些盐溶液反应外,还能够和二氧化碳等非金属氧化物反应,因此④处是非金属氧化物;故填:④(非金属氧化物);
(2)反应①是碱和盐的反应,而A是酸,Na2CO3、CuSO4、NaCl都是盐,但这三中盐中只有硫酸铜能和氢氧化钠反应生成硫酸钠和氢氧化铜沉淀,符合复分解反应发生的条件,所以选D;故填:D.
点评 本题考查了常见的碱的化学性质及复分解反应发生的条件,属于基础性的考查,难度不大.

练习册系列答案
相关题目
2.某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方 程式:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”.某研究性学习小组对该厂生产的烧碱样品进行如下探究.
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】猜想一:可能含有Na2C03,作出此猜想的依据是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
【交流与讨论】小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”.你认为他的观点不正确(填“正确”或“不正确”).
Ⅱ.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
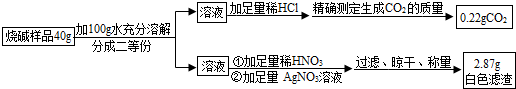
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程).
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】猜想一:可能含有Na2C03,作出此猜想的依据是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
Ⅱ.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:

请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程).
16.镧(La)元素的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水.由此判断下列几组物质,不能直接反应制取LaCl3的是( )
| A. | La(OH)3和HCl | B. | La2O3和HCl | C. | La和HCl | D. | NaCl和La(OH)3 |
17.鸡蛋主要为人体提供的营养素是( )
| A. | 糖类 | B. | 蛋白质 | C. | 油脂 | D. | 维生素 |

 如图所示,密闭玻璃管中,在A支管内放入5g镁粉,在B支管中放入KClO3和MnO2的混合物.将A、B支管同时加热,使两管内物质完全反应,若反应前后管内空气成分未发生变化,求最初放入B支管中的KClO3是多少克?
如图所示,密闭玻璃管中,在A支管内放入5g镁粉,在B支管中放入KClO3和MnO2的混合物.将A、B支管同时加热,使两管内物质完全反应,若反应前后管内空气成分未发生变化,求最初放入B支管中的KClO3是多少克?