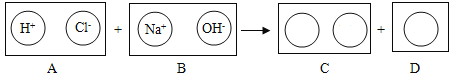
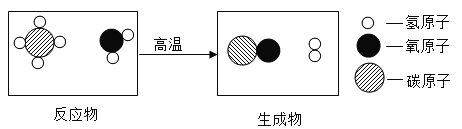
��Ŀ����
����Ŀ��ijͬѧ��ʵ��̨.�ϵ�һ����ɫ������Ʒ��������Ȥ,��ʦ������������ܺ���BaCl2��( NH4)2SO4��NH4Cl��CuSO4�е�һ�ֻ���,������ȡ��Ʒ����������ʵ��(���������ǡ����ȫ��Ӧ):

(1)A�Ļ�ѧʽ��______________________________��
(2)��ɫ������һ�����ڵ�������__________________________(�ѧʽ,��ͬ)�����ܺ��е�������__________________________��
(3)���ɰ�ɫ����E�Ļ�ѧ����ʽΪ__________________________;��ɫ��ҺD�е�������__________________________��
���𰸡�NH3 BaCl2��(NH4)2SO4 NH4Cl ![]() NH4NO3(�������)
NH4NO3(�������)
��������
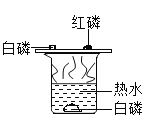
�������ʯ�һ����ĥ�ܲ�����������˰�ɫ�����к�����Σ��д̼�����ζ�������ǰ��������Ƴ�A�ǰ�������ɫ�����ˮ�γ���ɫ��Һ�Ͱ�ɫ����������ɫ��Һ��˵��ԭ��ɫ������һ��û������ͭ����Ϊ��ͭ���ӵ���Һ����ɫ������ɫ������˵��ԭ��ɫ������һ����BaCl2��(NH4)2SO4����Ϊ�������Ӧ���������ᱵ���������Ƴ�CΪ���ᱵ��������ɫ��ҺB����������Һ��Ӧ���ɰ�ɫ����E��˵��B��Һ�к��������ӣ��������Ӽȿ�������ԭ��ɫ�����е��Ȼ�泥�Ҳ��������BaCl2 ��(NH4)2SO4��Ӧ���ɵ��Ȼ�泥����ԭ��ɫ�����в�һ�����Ȼ�泥���ɫ��ҺB��NH4Cl��Һ����ɫ��ҺD��NH4NO3��Һ����ɫ����E���Ȼ���������
��1��A�ǰ�������ѧʽ�ǣ�NH3��
��2���ɷ�����֪����ɫ������һ�����ڵ�������BaCl2��(NH4)2SO4�����ܴ��ڵ�������NH4Cl��
��3����ɫ����EΪ�Ȼ������Ȼ������������Ӧ�����Ȼ�������������泥��仯ѧ��Ӧ����ʽΪ��![]() ��
��
��ɫ��ҺD�е��������Ȼ������������Ӧ���ɵ�NH4NO3(�������)��

����Ŀ��С���Ķ��������ϵ�֪����������ֽ�����ö������̻���������ͭ��������������������������ͭ������̽����Ȥ��
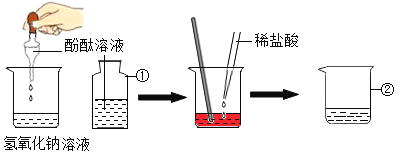
��������⣩����ͭ�Ƿ�Ҳ��������طֽ�Ĵ��������Ƿ�ȶ������̴�Ч�����ã�
�����ʵ�飩С�������ɵ����������Ϊ�����������������ʵ�飨��������Ӱ��ʵ������ؾ����ԣ���
ʵ����� | ��������� | ������������ | �������� |
�� | 1.2g | �� | |
�� | 1.2g | ����ͭ0.5g | |
�� | 1.2g | ��������0.5g |
��1������ʵ��Ӧ�����ġ��������ݡ���_____��
��2����ʵ��ڱ�ʵ��ٵġ��������ݡ���_____�����С������˵������ͭ�ܼӿ�����صķֽ����ʡ�
��3����ʵ��ڷ�Ӧ��Ĺ����ˮ�ܽ⡢���ˡ�ϴ�ӡ�����������õ�![]() ��ɫ��ĩ��˵��_____��
��ɫ��ĩ��˵��_____��
��4���ٽ���ɫ��ĩ�����Թ��У�����_____�����۲쵽_____��˵����ɫ��ĩ�Ļ�ѧ�����ڷ�Ӧǰ�ֲ��䡣
��Ԥ�ڽ��ۣ�����ͭҲ��������طֽ�Ĵ�����
��������ƣ�����ΪС�����ʵ��ۺ�ʵ��ڶԱȵ�Ŀ����_____��