题目内容
市售过碳酸钠(Na2CO4)中往往含有少量杂质碳酸钠,化学兴趣小组同学购得一包市售过碳酸钠样品,欲测定样品中过碳酸钠的质量分数:

【阅读资料】
①过碳酸钠和盐酸反应的化学方程式为2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
②常温常压下,氧气的密度为1.429g/L
③过碳酸钠通常用作洗衣粉的助剂,可以去除多种顽固污渍,同时清除细菌和异味.
【讨论探究】
甲同学认为可以通过测定反应生成的二氧化碳的体积,求得样品中过碳酸钠的质量分数;乙同学认为可以通过测定反应生成的氧气的体积,求得样品中过碳酸钠的质量分数.兴趣小组经过讨论后,认为甲同学的方案不合理.请你写出可能的原因 .
【定量测定】
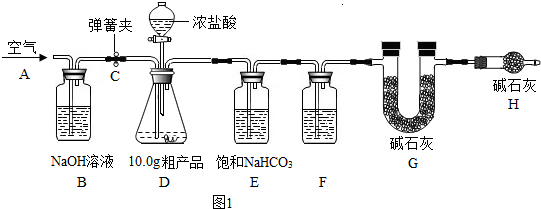
同学们根据乙同学的实验方案,设计了实验装置(如图所示),取8.0g样品投入烧瓶中,逐滴滴加盐酸直至不再产生气泡为止.
(1)装置B的作用是 .
(2)装置C的作用是 .
(3)通过排水量测定氧气的体积为672.0mL,请计算样品中过碳酸钠的质量分数是多少?(最后得数保留小数点后一位)
【定性实验】
同学们将过碳酸钠溶于热水中,将得到的溶液分成两份,往其中一份溶液加入MnO2,迅速冒出大量气泡,将带火星的木条伸入,木条复燃;另一份溶液等其不再产生气泡后,加入氯化钙溶液,产生白色沉淀.你推测过碳酸钠溶于水可能生成的物质是 .
【知识拓展】根据实验,你认为过碳酸钠应该如何保存 .

【阅读资料】
①过碳酸钠和盐酸反应的化学方程式为2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
②常温常压下,氧气的密度为1.429g/L
③过碳酸钠通常用作洗衣粉的助剂,可以去除多种顽固污渍,同时清除细菌和异味.
【讨论探究】
甲同学认为可以通过测定反应生成的二氧化碳的体积,求得样品中过碳酸钠的质量分数;乙同学认为可以通过测定反应生成的氧气的体积,求得样品中过碳酸钠的质量分数.兴趣小组经过讨论后,认为甲同学的方案不合理.请你写出可能的原因
【定量测定】
同学们根据乙同学的实验方案,设计了实验装置(如图所示),取8.0g样品投入烧瓶中,逐滴滴加盐酸直至不再产生气泡为止.
(1)装置B的作用是
(2)装置C的作用是
(3)通过排水量测定氧气的体积为672.0mL,请计算样品中过碳酸钠的质量分数是多少?(最后得数保留小数点后一位)
【定性实验】
同学们将过碳酸钠溶于热水中,将得到的溶液分成两份,往其中一份溶液加入MnO2,迅速冒出大量气泡,将带火星的木条伸入,木条复燃;另一份溶液等其不再产生气泡后,加入氯化钙溶液,产生白色沉淀.你推测过碳酸钠溶于水可能生成的物质是
【知识拓展】根据实验,你认为过碳酸钠应该如何保存
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,酸的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:【讨论探究】据杂质碳酸钠也与盐酸反应也能生成二氧化碳分析;
【定量测定】
(1)根据实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O,要测定氧气的量,必须先除去二氧化碳、氯化氢气体等,再根据实验装置图即可得出答案;
(2)二氧化碳能使澄清石灰水变浑浊,可利用此现象鉴别二氧化碳;
(3)先求出氧气的质量,再根据化学方程式中氧气与过碳酸钠的质量关系,即可列比例求解出样品中的过碳酸钠的质量,然后求其质量分数;
【定性实验】据质量守恒定律和反应的现象推测生成物;
【知识拓展】由过碳酸钠能够与水反应分析;
【定量测定】
(1)根据实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O,要测定氧气的量,必须先除去二氧化碳、氯化氢气体等,再根据实验装置图即可得出答案;
(2)二氧化碳能使澄清石灰水变浑浊,可利用此现象鉴别二氧化碳;
(3)先求出氧气的质量,再根据化学方程式中氧气与过碳酸钠的质量关系,即可列比例求解出样品中的过碳酸钠的质量,然后求其质量分数;
【定性实验】据质量守恒定律和反应的现象推测生成物;
【知识拓展】由过碳酸钠能够与水反应分析;
解答:解:【讨论探究】过碳酸钠与盐酸反应能生成二氧化碳,杂质碳酸钠与盐酸反应也能生成二氧化碳,所以通过测定二氧化碳体积求算过碳酸钠质量不准确
【定量测定】
(1)装置②中浓氢氧化钠的作用是除去二氧化碳和氯化氢气体;
(2)装置③中澄清石灰水的作用是验证二氧化碳是否被除尽;化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O
(3)解:设过碳酸钠的质量为x
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
2×122 32 (1分)
X 0.672L×1.429g/L
=
(1分)
X=7.3 g (1分)
×100%=91.5% (2分)
答:样品中过碳酸钠的质量分数是91.5%
【定性实验】由加入MnO2,迅速冒出大量气泡,将带火星的木条伸入,木条复燃可知,有过氧化氢存在;由加入氯化钙溶液,产生白色沉淀知,存在碳酸钠;
【知识拓展】由于过碳酸钠能够与水反应,故应放置在干燥处;
故答案为:【讨论探究】过碳酸钠与盐酸反应能生成二氧化碳,杂质碳酸钠与盐酸反应也能生成二氧化碳,所以通过测定二氧化碳体积求算过碳酸钠质量不准确.(2分)(其他合理答案均可)
【定量测定】(1)除去二氧化碳、氯化氢气体等 (2)检验二氧化碳是否除尽
(3)(5分)解:设过碳酸钠的质量为x
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
2×122 32 (1分)
X 0.672L×1.429g/L
=
(1分)
X=7.3 g (1分)
×100%=91.5% (2分)
答:样品中过碳酸钠的质量分数是91.5%
【定性实验】H2O2 Na2CO3 (各1分)
【知识拓展】放置在干燥处
【定量测定】
(1)装置②中浓氢氧化钠的作用是除去二氧化碳和氯化氢气体;
(2)装置③中澄清石灰水的作用是验证二氧化碳是否被除尽;化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O
(3)解:设过碳酸钠的质量为x
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
2×122 32 (1分)
X 0.672L×1.429g/L
| x |
| 0.672 L×1.429g/L |
| 2×122 |
| 32 |
X=7.3 g (1分)
| 7.3g |
| 8.0g |
答:样品中过碳酸钠的质量分数是91.5%
【定性实验】由加入MnO2,迅速冒出大量气泡,将带火星的木条伸入,木条复燃可知,有过氧化氢存在;由加入氯化钙溶液,产生白色沉淀知,存在碳酸钠;
【知识拓展】由于过碳酸钠能够与水反应,故应放置在干燥处;
故答案为:【讨论探究】过碳酸钠与盐酸反应能生成二氧化碳,杂质碳酸钠与盐酸反应也能生成二氧化碳,所以通过测定二氧化碳体积求算过碳酸钠质量不准确.(2分)(其他合理答案均可)
【定量测定】(1)除去二氧化碳、氯化氢气体等 (2)检验二氧化碳是否除尽
(3)(5分)解:设过碳酸钠的质量为x
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
2×122 32 (1分)
X 0.672L×1.429g/L
| x |
| 0.672 L×1.429g/L |
| 2×122 |
| 32 |
X=7.3 g (1分)
| 7.3g |
| 8.0g |
答:样品中过碳酸钠的质量分数是91.5%
【定性实验】H2O2 Na2CO3 (各1分)
【知识拓展】放置在干燥处
点评:本题考查实验装置和混合物中样品纯度的计算.有关化学方程式的计算,要注意带入方程式计算的必须是实际参加反应或实际生成的物质质量,否则就会造成实验结果的偏大或偏小.

练习册系列答案
相关题目








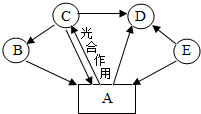 A、B、C、D、E是初中化学常见物质,转化关系如图(图中部分反应物、生成物及反应条件被省略):已知B是一种红色固体,相对分子质量为160,A能使澄清石灰水变浑浊,E是化学实验室常用燃料的主要成分,请回答下列问题:
A、B、C、D、E是初中化学常见物质,转化关系如图(图中部分反应物、生成物及反应条件被省略):已知B是一种红色固体,相对分子质量为160,A能使澄清石灰水变浑浊,E是化学实验室常用燃料的主要成分,请回答下列问题: