题目内容
13.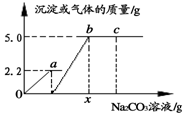 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如右图所示.下列说法正确的是( )
向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如右图所示.下列说法正确的是( )| A. | a点溶液中溶质有2种 | B. | b点溶液的pH>7 | ||
| C. | x值为10.6 | D. | 图中bc段表示生成沉淀的过程 |
分析 根据加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了进行分析.
解答 解:A、向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液,碳酸钠会先与盐酸反应,a点时盐酸和碳酸钠完全反应生成氯化钠和水、二氧化碳,溶液中的溶质含有氯化钠、氯化钙两种,故A正确;
B、b点碳酸钠和盐酸、氯化钙完全反应,所以此溶液的pH=7,故B错误;
C、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.
设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀5.0g所需Na2CO3的质量为z,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
y 2.2g
$\frac{106}{y}$=$\frac{44}{2.2g}$
y=5.3g;
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
z 5.0g
$\frac{106}{z}$=$\frac{100}{5g}$
z=5.3g;
所以x=$\frac{5.3g+5.3g}{10%}$=106.0g,故C错误;
D、通过分析图象中的变化趋势可知,bc段表示完全反应,加入的碳酸钠过量,故D错误.
故选:A.
点评 解答本题关键要知道只有把盐酸反应完了,才能与氯化钙反应产生沉淀,因为如果碳酸钠与氯化钙先反应生成了碳酸钙沉淀,也会被剩余的盐酸溶解掉,将不会看到沉淀.

| A. | 氢氧化钠固体在空气中会变质 | B. | 夜来香在空气中散发出迷人的香味 | ||
| C. | 打开浓盐酸,瓶口会产生白雾 | D. | 铁在潮湿的空气中会生锈 |
| 温度/℃ | 10 | 30 | 50 | 70 | |
| 溶解度/g | NH4Cl | 33.3 | 41.4 | 50.4 | 55.2 |
| KNO3 | 20.9 | 45.8 | 85.5 | 110 | |
(1)从上表可知,50℃时,NH4Cl的溶解度为50.4g.
(2)NH4Cl和KNO3的溶解度受温度影响比较大的物质是KNO3(填化学式).
(3)欲配制质量分数为10%的KNO3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和玻璃棒.
(4)烧杯中A中是60℃时,含有100g水的NH4Cl不饱和溶液,经过如图1的变化过程(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为133.3g.
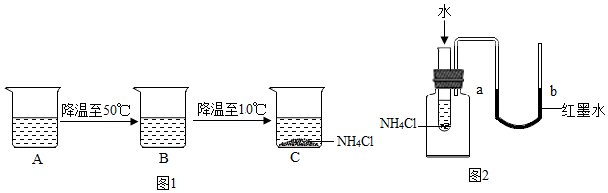
(5)某同学欲验证NH4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到A现象得以验证.
A.a端液面高于b端液面
B.a端液面低于b端液面.
| 名称 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 化学式 | CH4 | C2H6 | C3H8 | ? | C5H12 |
| 沸点(℃) | -164 | -88.6 | -42.1 | -0.5 | 36.1 |
| 相对密度 | 0.466 | 0.572 | 0.585 | 0.579 | 0.626 |
(1)写出表中丁烷的化学式C4H10.
(2)烷烃的命名与碳原子数目的增加有关,请总结一条烷烃物理性质的递变规律随着碳原子数目增加,沸点越来越高,相对密度越来越大.
(3)烷烃在工业上的用途非常广泛,它的进一步开发利用也成为研究话题,以下烷烃的性质描述中,
属于不支持对它进一步开发利用的观点有:D.
A.烷烃能做燃料,反应放热极多,其中的甲烷已成为广泛使用的清洁能源
B.地球上的烷烃总含量较少,以甲烷居多,且分布随纬度的变化很大
C.常温常压下,随碳原子增多,烷烃逐渐从气态变成液态再变成固体
D.烷烃不易发生反应,制取成本较高,且只能从石油中提取.
| A. | 溶液都是无色、透明的 | B. | 均一、稳定的液体都是溶液 | ||
| C. | 硝酸铵溶于水,使溶液的温度降低 | D. | 纯净水是纯净物 |
| A. | 在我们的日常生活中出现了“加碘食盐”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品.这里的碘、铁、钙、硒、氟应理解为元素 | |
| B. | 严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收 | |
| C. | 长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成“负压”的缘故 | |
| D. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故 |