题目内容
1.写出下列物质的化学式:(1)少量存在于胃液中,以助消化的是HCl
(2)可用于降低土壤酸性的是Ca(OH)2
(3)可用于某些气体的干燥,具有强腐蚀性和吸水性的液体是H2SO4
(4)最简单的有机物CH4.
分析 根据物质的性质与用途确定物质名称,然后根据物质化学式的写法来分析.化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零.
解答 解:(1)胃酸中含有盐酸,起到了帮助消化的作用,故填:HCl;
(1)氢氧化钙是一种碱,能改良酸性土壤,故填:Ca(OH)2;
(3)浓硫酸具有强腐蚀性,具有吸水性,可用作某些气体的干燥剂,故填:H2SO4;
(4)甲烷是结构最简单的有机物,故填:CH4.
点评 只要掌握了常见物质的用途,再根据化学式的写法就可以写出化学式完成本题.

练习册系列答案
相关题目
17.请根据酸、碱、盐的相关知识,回答下列问题:
(1)海水的pH约为8.6,海水呈碱性是溶液中含有OH-微粒.海水中含量最多的溶质是水.
(2)水壶中水垢的主要成分是碳酸钙,生活中清除水垢时,可往水壶中加入一种适量的厨房中常用的调味品,该调味品是食醋,因含有H+微粒可除去不溶性碳酸钙.
(3)饱和食盐水常用于生产氯气、烧碱等,已知95℃时食盐的溶解度为39g,配制95℃时100Kg饱和食盐水,需食盐至少28.06Kg,电解得含氢氧化钠质量分数30%,含氯化钠质量分数4%的混合溶液,为了获取氢氧化钠固体,采取的三个操作是加热浓缩、降温结晶、过滤.
(1)海水的pH约为8.6,海水呈碱性是溶液中含有OH-微粒.海水中含量最多的溶质是水.
(2)水壶中水垢的主要成分是碳酸钙,生活中清除水垢时,可往水壶中加入一种适量的厨房中常用的调味品,该调味品是食醋,因含有H+微粒可除去不溶性碳酸钙.
(3)饱和食盐水常用于生产氯气、烧碱等,已知95℃时食盐的溶解度为39g,配制95℃时100Kg饱和食盐水,需食盐至少28.06Kg,电解得含氢氧化钠质量分数30%,含氯化钠质量分数4%的混合溶液,为了获取氢氧化钠固体,采取的三个操作是加热浓缩、降温结晶、过滤.
| 溶解度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 氢氧化钠 | 109 | 129 | 174 | 314 | 347 |
| 氯化钠 | 36.0 | 36.4 | 37 | 38.2 | 40 |
9.化学影响着社会的发展和人们的生活质量,以下说法正确的是( )
| A. | 将草木灰和碳铵混合施用有利于提高肥效 | |
| B. | 为了加强食品的色、香、味,可以大量使用添加剂 | |
| C. | 不能在铁制容器中配置波尔多液农药 | |
| D. | 焚烧废旧塑料可以解决“白色污染”问题 |
16.如图表示的是身边一些物质在常温下的近似pH,相关说法正确的是( )


| A. | 草木灰水的碱性最强 | B. | 橘子汁显碱性 | ||
| C. | 柠檬的酸性比橘子弱 | D. | 萝卜显中性 |
6.以下几种实验操作,正确的是( )
| A. |  称量固体NaOH | B. | 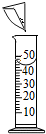 在量筒内配制食盐水 | ||
| C. | 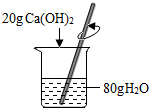 配制20%的Ca(OH)2溶液 | D. | 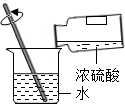 将浓H2SO4稀释成稀H2SO4 |
13.某研究性学习小组,进行电解水的实验,测定两极逸出气体的体积,记录于表.
(1)如何验证正极产生的气体将带火星的木条伸入试管中,木条复燃,证明是氧气.
(2)自4(时间)起,每分钟内负极与正极产生的气体体积比为理论比值.
| 电解时间 (分) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 负极生成的气体(毫升) | 8 | 16 | 25 | 34 | 44 | 54 | 64 | 74 |
| 正极生成的气体 (毫升) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 |
(2)自4(时间)起,每分钟内负极与正极产生的气体体积比为理论比值.
10.关于下列化学用语的说法正确的是( )
①N2 ②Ca2+ ③NaNO2 ④ ⑤
⑤
①N2 ②Ca2+ ③NaNO2 ④
 ⑤
⑤
| A. | ①可表示2个氮原子 | B. | ③中氮元素的化合价为-3价 | ||
| C. | ④和⑤是同种元素 | D. | ②和⑤均表示阳离子 |
 某化学兴趣小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图实验:在A实验中发生反应的化学方程式为Fe+CuSO4=Cu+FeSO4.将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤.滤渣中:一定含有的物质是铜,可能含有的物质是铁.为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是②⑤(填写序号).
某化学兴趣小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图实验:在A实验中发生反应的化学方程式为Fe+CuSO4=Cu+FeSO4.将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤.滤渣中:一定含有的物质是铜,可能含有的物质是铁.为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是②⑤(填写序号).