题目内容
16.金属是一类重要的材料,人类的生活和生产都离不开金属.下图表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.
(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关①③.
①金属冶炼的难易程度 ②金属的导电性 ③金属的活动性 ④地壳中金属元素的含量
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿里还原出来的化学方程式3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(3)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟水、氧气等物质相互作用的结果.
(4)铝的活动性比铁强,但铝与空气中却表现出良好的抗蚀性,其原因铝的表面生成致密的氧化铝薄膜(或氧化膜),隔绝了铝与空气的接触.
(5)世界卫生组织把金属铝列为食品污染源之一,指出每人每日铝的安全摄入量应控制在
4毫克以下.某饮食店用1000克面粉、4克明矾[化学式为KAl(SO4)2•12H2O]、小苏打、食盐等辅料加适量水,烹炸得油条24根,平均每根50克.问:
①明矾的相对分子质量为474;
②明矾中钾元素、铝元素、硫元素、氧元素、氢元素的质量比为39:27:64:320:24.
③已知明矾中铝元素的质量分数为5.7%,求4克明矾中铝元素的质量为0.228g.
分析 (1)金属的利用与金属的活动性和金属的冶炼难易有关;
(2)根据炼铁的原理写出反应的化学方程式;
(3)铁在有水和氧气并存时易生锈;
(4)铝在空气中表面易被氧化生成致密的氧化铝薄膜,据此分析回答;
(5)根据化学式的意义进行有关的计算.
解答 解:(1)金属大规模地开发利用的先后的顺序与金属的活动性和金属冶炼的难易程度有关,金属越活泼越不容易冶炼用的越晚;
(2)一氧化碳在高温条件下把铁从赤铁矿里还原出来,反应的化学方程式 为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)铁在与氧气和水共同存在时容易生锈;
(4)铝在空气中表面易被氧化成致密的氧化膜,表现出很好的抗腐蚀性,所以填铝表面有致密的氧化铝保护膜;
(5)①明矾的相对分子质量为:39+27+(32+16×4)×3+12×18=474;
②明矾中钾元素、铝元素、硫元素、氧元素、氢元素的质量比为:39:27:(32×2):
(16×20):(1×24)=39:27:64:320:24.
③已知明矾中铝元素的质量分数为5.7%,4克明矾中铝元素的质量为:4g×5.7%=0.228g.
故答为:(1)①③;(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(3)水; 氧气、空气;(4)铝的表面生成致密的氧化铝薄膜(或氧化膜),隔绝了铝与空气的接触;(5)474;39:27:64:320:24;0.228g.
点评 解答本题关键是要知道金属越活泼越不容易冶炼用的越晚,知道铁生锈的条件,铝易被氧化,理解化学式的意义会进行有关的计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  读取液体体积 | B. |  给液体加热 | C. |  取用固体粉末 | D. |  过滤 |
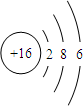
| A. | 该原子的核内电子数为16 | B. | 该原子最外电子层达到了稳定结构 | ||
| C. | X 属于非金属元素 | D. | X 与Na 生成化合物NaX |
| A. | 若C、D分别为单质和化合物,则该反应一定是置换反应 | |
| B. | 若C、D分别为盐和水,则该反应一定是中和反应 | |
| C. | 若A、B、C、D都是化合物,该反应一定是复分解反应 | |
| D. | 若A为碱溶液,B为盐溶液,则C和D可能是两种沉淀 |
| A. | 原子、分子都能构成物质 | B. | 原子、分子总是在不断地运动 | ||
| C. | 分子可以再分,原子不能再分 | D. | 原子、分子间都有一定的间隔 |
下表列出了除去物质中所含少量杂质的方法,其中正确的是
选项 | 物质 | 所含杂质 | 除去杂质的方法 |
A | N2 | O2 | 将气体缓缓通过足量的灼热焦炭 |
B | CaO | CaCO3 | 加水溶解、过滤 |
C | Fe | Zn | 加入过量的稀盐酸,过滤,洗涤,干燥 |
D | FeCl2溶液 | CuCl2溶液 | 加入过量的铁粉, 过滤 |
A. A B. B C. C D. D
| 溶液名称 | 稀硫酸 | 石灰水 | 医用酒精 | 碘酒 | 盐酸 | 汽水 |
| 溶质 | ||||||
| 溶剂 |
 如图是关于铜及其化合物的知识网络图,“→”表示一种物质转化成另一种物质.A、B、C分别是不同类别的铜的化合物,其中A物质为黑色粉末,B物质易溶于水.
如图是关于铜及其化合物的知识网络图,“→”表示一种物质转化成另一种物质.A、B、C分别是不同类别的铜的化合物,其中A物质为黑色粉末,B物质易溶于水.