题目内容
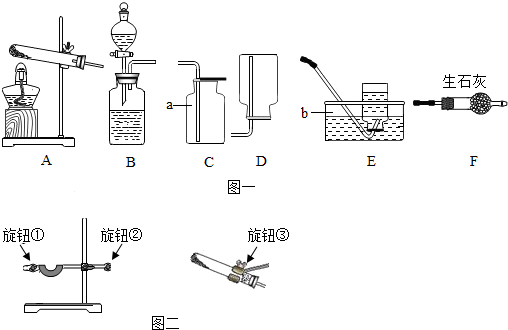
17.下图是某兴趣小组设计的四个实验装置,其中实验操作设计正确的是( )| A. |  稀释浓硫酸 | B. |  探究可燃物燃烧的条件 | ||
| C. |  验证质量守恒定律 | D. |  配制氯化钠溶液 |
分析 A、在稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断的搅拌;
B、燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,据此进行分析判断;
C、在验证质量守恒定律时,若有气体参加或生成的实验必须在密闭的环境中进行;
D、量筒不能用来配置溶液.
解答 解:A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作设计错误.
B、实验可观察到的实验现象是:铜片上的白磷燃烧,而铜片上的红磷不燃烧,说明燃烧温度要达到着火点;铜片上的白磷燃烧,水中的白磷不燃烧,说明燃烧需要氧气;可得出燃烧的条件,图中所示操作设计正确.
C、锌与稀硫酸反应生成氢气,由于装置是敞口装置,产生的氢气逸出,不能用于验证质量守恒定律,图中所示操作设计错误;
D、应该在烧杯中配置氯化钠溶液,图中所示操作设计错误;
故选:B.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.

练习册系列答案
相关题目
12.下列关于科学实验的“操作-现象-结论”的描述正确的是( )
| A. | 在某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐 | |
| B. | 在某溶液中加入氯化钡溶液和稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子 | |
| C. | 某溶液用pH试纸测试,试纸变蓝色(pH约为10),该溶液一定是碱性溶液 | |
| D. | 将带火星的木条伸入集气瓶中,木条复燃,该气体(氧气)已收集满 |
9.称量氢氧化钠时,要将氢氧化钠放入烧杯或表面皿内进行称量( )
| A. | 氢氧化钠易溶于水 | B. | 氢氧化钠易潮解、变质 | ||
| C. | 氢氧化钠易挥发 | D. | 氢氧化钠溶于水会放出大量的热 |
6. 雨、雪在形成和降落过程中可吸收、溶解空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨.请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中可吸收、溶解空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨.请回答下列有关酸雨的问题:
(1)要测定某地采集到的雨水是否为酸雨,在下列提供的试剂(试纸)中宜取用D.
A.蓝色石蕊试纸 B.紫色石蕊溶液 C.无色酚酞试剂 D.pH试纸
(2)已知 CO2的饱和溶液常温下pH不小于 5.6.通常空气中CO2的含量大于SO2的含量,但人们反而将空气中的 SO2认定为形成酸雨的主要原因之一.有同学想通过如图实验寻找证据,你认为下一步的实验步骤是测定溶液的酸碱度,只要出现pH值小于5.6的实验结果,就可认定SO2溶于水有形成酸雨的可能.
(3)已知SO2与 CO2有许多化学性质是相似的.亚硫酸钙(CaSO3)是白色、难溶于水但可溶于酸的固体.某同学向一酸雨样品中滴加 CaCl2溶液(如图),观察到没有浑浊现象,继续滴入NaOH溶液后即有白色沉淀产生.则在以上过程中不可能发生的化学反应是A
A SO2+CaCl2+H2O═CaSO3↓十2HCl.
B.SO2+2NaOH═Na2SO3+H2O
C. Na2SO3+CaCl2=CaSO3↓+2NaCl
D.H2SO3+2NaOH=Na2SO3+2H2O
E.SO2+H2O═H2SO3.
 雨、雪在形成和降落过程中可吸收、溶解空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨.请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中可吸收、溶解空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨.请回答下列有关酸雨的问题:| 实验序号 | X的用量/g | Y的用量/g | 生成X2Y的质量/g |
| 1 | 6.4 | 1.8 | 7.2 |
| 2 | 9 | 3.6 | 12.0 |
A.蓝色石蕊试纸 B.紫色石蕊溶液 C.无色酚酞试剂 D.pH试纸
(2)已知 CO2的饱和溶液常温下pH不小于 5.6.通常空气中CO2的含量大于SO2的含量,但人们反而将空气中的 SO2认定为形成酸雨的主要原因之一.有同学想通过如图实验寻找证据,你认为下一步的实验步骤是测定溶液的酸碱度,只要出现pH值小于5.6的实验结果,就可认定SO2溶于水有形成酸雨的可能.
(3)已知SO2与 CO2有许多化学性质是相似的.亚硫酸钙(CaSO3)是白色、难溶于水但可溶于酸的固体.某同学向一酸雨样品中滴加 CaCl2溶液(如图),观察到没有浑浊现象,继续滴入NaOH溶液后即有白色沉淀产生.则在以上过程中不可能发生的化学反应是A
A SO2+CaCl2+H2O═CaSO3↓十2HCl.
B.SO2+2NaOH═Na2SO3+H2O
C. Na2SO3+CaCl2=CaSO3↓+2NaCl
D.H2SO3+2NaOH=Na2SO3+2H2O
E.SO2+H2O═H2SO3.

 2011年3月22日是第二十三个“世界水日”,今年“世界水日”的主题是“应对水短缺”.请回答下列有关问题:
2011年3月22日是第二十三个“世界水日”,今年“世界水日”的主题是“应对水短缺”.请回答下列有关问题: