题目内容
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,进行锌、铁、铜的金属活动性顺序探究等实验.
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示: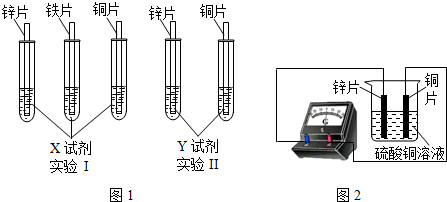
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色.他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至 色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转 (选填“是”或“否”);
②铜片表面变粗.
(1)实验前,用砂纸打磨金属片的目的是
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示:

若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色.他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式:
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转
②铜片表面变粗.
考点:金属活动性的探究,化学式的书写及意义,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)根据金属在空气中其表面会生成一层氧化膜,氧化膜会先与酸反应生成盐和水,几乎不能生成氢气进行分析;
(2)根据金属活动顺序表中位于前面的金属能将位于后面的金属从其盐溶液中置换出来,氢前面的金属能与酸反应生成氢气等知识进行设计实验;
(3)A、根据锌的活动性比铜和铁强,可以和其盐溶液发生置换反应,从而溶液的颜色也随之发生改变进行分析;
B、根据强金属和弱金属的盐溶液会发生置换反应进行分析;
(4)根据原电池的电子转移及电流的形成以及发生的变化进行分析.
(2)根据金属活动顺序表中位于前面的金属能将位于后面的金属从其盐溶液中置换出来,氢前面的金属能与酸反应生成氢气等知识进行设计实验;
(3)A、根据锌的活动性比铜和铁强,可以和其盐溶液发生置换反应,从而溶液的颜色也随之发生改变进行分析;
B、根据强金属和弱金属的盐溶液会发生置换反应进行分析;
(4)根据原电池的电子转移及电流的形成以及发生的变化进行分析.
解答:解:(1)金属在空气中其表面会生成一层氧化膜,氧化膜会阻止金属与药品接触,要先除去氧化膜,所以实验前,用砂纸打磨金属片的目的是除去金属表面的氧化膜:
(2)实验1:给定三种金属,因此可以和酸混合:将三种金属分别与硫酸混合后,铜与稀硫酸不反应,锌、铁均能与稀硫酸反应生成气体,且锌的反应比铁剧烈,可以得出锌>铁>铜;
实验2:给定两种金属,可以和中间金属的盐溶液混合,由于锌能与硫酸亚铁反应,说明锌在铁的前面,铜不与硫酸亚铁反应,说明铜在铁的后面,所以可以选用的另一种药品是硫酸亚铁;
(3)A、硫酸亚铁溶液是浅绿色,硫酸铜溶液是蓝色,两种溶液混合后呈现青色,加入过量的锌粉后,先和硫酸铜溶液发生置换反应,青色变浅,硫酸铜完全反应后,溶液变为浅绿色,锌再与硫酸亚铁发生置换反应,生成硫酸锌,溶液呈现无色;
B、锌和硫酸亚铁反应生成硫酸锌和铁,锌和硫酸铜反应生成硫酸锌和铜,化学方程式为:Zn+FeSO4═ZnSO4+Fe,Zn+CuSO4=ZnSO4+Cu;
(4)原电池中锌比铜活泼,所以锌失去电子,电子从锌片流向铜片,而电流从铜片流向锌片,所以电流表指针发生偏转.
故答案为:(1)除去金属表面的氧化膜;
(2)H2SO4、FeSO4;
(3)浅绿,Zn+FeSO4═ZnSO4+Fe,Zn+CuSO4=ZnSO4+Cu;
(4)是.
(2)实验1:给定三种金属,因此可以和酸混合:将三种金属分别与硫酸混合后,铜与稀硫酸不反应,锌、铁均能与稀硫酸反应生成气体,且锌的反应比铁剧烈,可以得出锌>铁>铜;
实验2:给定两种金属,可以和中间金属的盐溶液混合,由于锌能与硫酸亚铁反应,说明锌在铁的前面,铜不与硫酸亚铁反应,说明铜在铁的后面,所以可以选用的另一种药品是硫酸亚铁;
(3)A、硫酸亚铁溶液是浅绿色,硫酸铜溶液是蓝色,两种溶液混合后呈现青色,加入过量的锌粉后,先和硫酸铜溶液发生置换反应,青色变浅,硫酸铜完全反应后,溶液变为浅绿色,锌再与硫酸亚铁发生置换反应,生成硫酸锌,溶液呈现无色;
B、锌和硫酸亚铁反应生成硫酸锌和铁,锌和硫酸铜反应生成硫酸锌和铜,化学方程式为:Zn+FeSO4═ZnSO4+Fe,Zn+CuSO4=ZnSO4+Cu;
(4)原电池中锌比铜活泼,所以锌失去电子,电子从锌片流向铜片,而电流从铜片流向锌片,所以电流表指针发生偏转.
故答案为:(1)除去金属表面的氧化膜;
(2)H2SO4、FeSO4;
(3)浅绿,Zn+FeSO4═ZnSO4+Fe,Zn+CuSO4=ZnSO4+Cu;
(4)是.
点评:本题主要考查了金属活动性顺序的应用和原电池的原理,在平时的学习中应当熟练掌握前面的金属能将后面的金属从其盐溶液中置换出来,活动性差别越大越容易置换,注意掌握原电池中电子的方向和电流的方向.

练习册系列答案
相关题目
下列图象能正确反映所对应叙述关系的是( )
A、 该图表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系 |
B、 该图表示t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入量的关系 |
C、 该图表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系 |
D、 该图表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系 |
 某实验小组根据如图所示装置探究燃烧的条件,请回答问题.
某实验小组根据如图所示装置探究燃烧的条件,请回答问题. 如图是实验室常用的两种气体制备、收集或净化的多种功能装置.
如图是实验室常用的两种气体制备、收集或净化的多种功能装置.