题目内容
 在实验室里,某同学看到氢氧化钠试剂瓶的瓶口有白色粉末,如图所示:
在实验室里,某同学看到氢氧化钠试剂瓶的瓶口有白色粉末,如图所示:他对白色粉末的成分作出了一些猜测:
猜测一:可能是碳酸钠,该猜想的依据是
(用化学方程式表示)
猜测二:可能是氧氧化钠 猜测三:可能是氧氧化钠和碳酸钠
为探究白色粉末的成分,他将该粉末溶于水,得到无色溶液,再迸行了如下实验:
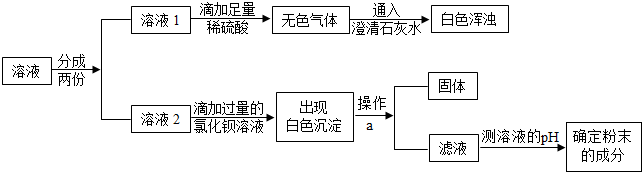
(1)操作a的名称是
(2)根据实验现象推测,无色气体是
(3)在溶液2中滴加过量氯化钡溶液的化学反应方程式为
(4)若测得滤液的pH=7,则猜测
考点:药品是否变质的探究,碱的化学性质,溶液的酸碱性与pH值的关系,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:猜测一:氢氧化钠能够吸收空气中的二氧化碳,并且能够反应生成碳酸钠和水;
(1)过滤可以把不溶于水的物质除去,玻璃棒的用途有搅拌、引流、转移物质等;
(2)二氧化碳能使澄清石灰水变浑浊;
(3)碳酸钠和氯化钡反应生成碳酸钡白色沉淀和氯化钠;
(4)氯化钡溶液显中性,氢氧化钠溶液显碱性,根据滤液的pH可以判断白色粉末的组成.
(1)过滤可以把不溶于水的物质除去,玻璃棒的用途有搅拌、引流、转移物质等;
(2)二氧化碳能使澄清石灰水变浑浊;
(3)碳酸钠和氯化钡反应生成碳酸钡白色沉淀和氯化钠;
(4)氯化钡溶液显中性,氢氧化钠溶液显碱性,根据滤液的pH可以判断白色粉末的组成.
解答:解:猜测一:氢氧化钠和二氧化碳反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故填:2NaOH+CO2═Na2CO3+H2O
(1)操作a的名称是过滤;该操作用到玻璃棒的作用是引流.
故填:过滤;引流.
(2)根据实验现象推测,无色气体是二氧化碳,白色沉淀是碳酸钙.
故填:二氧化碳;碳酸钙.
(3)在溶液2中滴加过量氯化钡溶液的化学反应方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl.
故填:BaCl2+Na2CO3=BaCO3↓+2NaCl.
(4)若测得滤液的pH=7,说明白色粉末中不含有氢氧化钠,则猜测一是正确的;若测得滤液的pH>7,说明白色粉末中含有氢氧化钠,则猜测三是正确的.
故填:一;三.
故填:2NaOH+CO2═Na2CO3+H2O
(1)操作a的名称是过滤;该操作用到玻璃棒的作用是引流.
故填:过滤;引流.
(2)根据实验现象推测,无色气体是二氧化碳,白色沉淀是碳酸钙.
故填:二氧化碳;碳酸钙.
(3)在溶液2中滴加过量氯化钡溶液的化学反应方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl.
故填:BaCl2+Na2CO3=BaCO3↓+2NaCl.
(4)若测得滤液的pH=7,说明白色粉末中不含有氢氧化钠,则猜测一是正确的;若测得滤液的pH>7,说明白色粉末中含有氢氧化钠,则猜测三是正确的.
故填:一;三.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图是A、B、C三种物质的溶解度曲线,下列所获信息正确的是( )
如图是A、B、C三种物质的溶解度曲线,下列所获信息正确的是( )| A、在50℃时,A物质的溶解度为50 |
| B、当A中混有少量B、C时,可采用蒸发溶剂的方法提纯A |
| C、相同质量的水分别溶解A、B、C达到饱和状态时,所溶解的质量A>B>C |
| D、将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A>C |
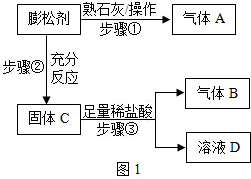 网友曝出某食品加工厂竟然将碳酸氢铵当做膨松剂加入面粉中制作饼干.某化学研究小组同学对此产生了疑问,并进行了科学探究活动.
网友曝出某食品加工厂竟然将碳酸氢铵当做膨松剂加入面粉中制作饼干.某化学研究小组同学对此产生了疑问,并进行了科学探究活动.
 某班同学用右图装置测定空气里氧气的含量.先用弹簧夹夹住橡皮管.点燃红磷伸入瓶中并塞上瓶塞.待红磷熄灭后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用右图装置测定空气里氧气的含量.先用弹簧夹夹住橡皮管.点燃红磷伸入瓶中并塞上瓶塞.待红磷熄灭后,打开弹簧夹,观察广口瓶内水面变化情况. 如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.
如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.