题目内容

(1)在上面元素周期表中全部是金属元素的区域为
(A)a (B)b (C)c (D)d
(2)G元素与 E元素形成的化合物的化学式是
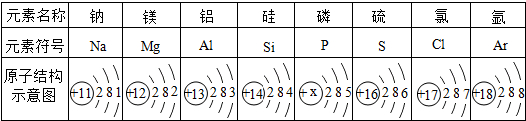
(3)①用元素符号将铁元素填写在上面元素周期表中对应的位置.
②G、H两元素相比较,金属性较强的是
(a)看那种原子失去的电子越多,金属性越强.
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
考点:元素周期表的特点及其应用,化学式的书写及意义
专题:化学用语和质量守恒定律
分析:由元素在周期表中的位置可知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Al,I为Cl,
(1)图中只有b为过渡元素,均为金属;
(2)G元素与E元素形成的化合物为氧化钠、过氧化钠,都含离子键;以上元素中钠的金属性最强,Al的氢氧化物为两性,Cl的最高价含氧酸的酸性最强;
(3)①Fe位于第四周期第ⅤⅢ族;
②Na、Mg相比,Na的金属性强,可利用失去电子的能力、与相同物质反应的快慢、最高价氧化物的碱性等来比较金属性.
(1)图中只有b为过渡元素,均为金属;
(2)G元素与E元素形成的化合物为氧化钠、过氧化钠,都含离子键;以上元素中钠的金属性最强,Al的氢氧化物为两性,Cl的最高价含氧酸的酸性最强;
(3)①Fe位于第四周期第ⅤⅢ族;
②Na、Mg相比,Na的金属性强,可利用失去电子的能力、与相同物质反应的快慢、最高价氧化物的碱性等来比较金属性.
解答:解:由元素在周期表中的位置可知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Al,I为Cl,
(1)图中只有b为过渡元素,均为金属,故答案为:(B);
(2)G元素与E元素形成的化合物为氧化钠、过氧化钠,化学式分别为Na2O、Na2O2,都含离子键,均为离子化合物;以上元素中钠的金属性最强,则NaOH的碱性最强,Cl的最高价含氧酸HClO4酸性最强,Al的氢氧化物Al(OH)3为两性,
故答案为:Na2O;Na2O2;离子化合物;NaOH;HClO4;Al(OH)3;
(3)①Fe位于第四周期第ⅤⅢ族,如 ,
,
故答案为 ;
;
②Na、Mg相比,Na的金属性强,
(a)看那种原子失去的电子越多,不能比较金属性,故不选;
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应,反应快的金属性强,故选;
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,反应快的金属性强,故选;
(d)比较这两种元素的气态氢化物的稳定性,可比较非金属性,不比较金属性,故不选;
故答案为:(b)(c).
(1)图中只有b为过渡元素,均为金属,故答案为:(B);
(2)G元素与E元素形成的化合物为氧化钠、过氧化钠,化学式分别为Na2O、Na2O2,都含离子键,均为离子化合物;以上元素中钠的金属性最强,则NaOH的碱性最强,Cl的最高价含氧酸HClO4酸性最强,Al的氢氧化物Al(OH)3为两性,
故答案为:Na2O;Na2O2;离子化合物;NaOH;HClO4;Al(OH)3;
(3)①Fe位于第四周期第ⅤⅢ族,如
 ,
,故答案为
 ;
;②Na、Mg相比,Na的金属性强,
(a)看那种原子失去的电子越多,不能比较金属性,故不选;
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应,反应快的金属性强,故选;
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,反应快的金属性强,故选;
(d)比较这两种元素的气态氢化物的稳定性,可比较非金属性,不比较金属性,故不选;
故答案为:(b)(c).
点评:本题考查位置、结构、性质的关系及应用,熟悉元素的位置推断元素是解答的关键,注意把握金属性的比较和元素周期律,题目难度中等.

练习册系列答案
相关题目
 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的( )
甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的( )| A、甲物质的溶解度为60g |
| B、t℃时,甲、乙两物质的溶解度相等 |
| C、升高温度可使不饱和的甲溶液变为饱和溶液 |
| D、t℃乙物质的饱和溶液降到20℃时,溶液中溶质质量分数变小 |
 如图是元素周期表中某元素的信息示意图,从中获取的相关信息不正确的是
如图是元素周期表中某元素的信息示意图,从中获取的相关信息不正确的是 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.