题目内容
2.用合适的物质填空(1)检验盐酸和可溶性的盐酸盐可用硝酸银溶液和稀硝酸.
(2)检验硫酸和可溶性的硫酸盐可用硝酸钡溶液和稀硝酸.
(3)检验碳酸盐可用稀盐酸和澄清的石灰水.
(4)检验铵盐可用熟石灰和湿润的红色石蕊试纸.
分析 (1)根据检验溶液中是否含有Cl-,可用酸化的硝酸银溶液,进行分析解答.
(2)检验溶液中是否含有SO42-,可用酸化的硝酸钡溶液,进行分析解答.
(3)根据碳酸盐能与酸反应生成能使澄清石灰水变浑浊的二氧化碳气体,检验碳酸盐最简单的方法是滴加稀盐酸,观察是否有能使澄清石灰水变混浊的气体产生.
(4)根据铵盐的检验方法,进行分析解答.
解答 解:(1)检验盐酸和可溶性的盐酸盐,即检验溶液中是否含有Cl-,可用酸化的硝酸银溶液,一般用硝酸银溶液和稀硝酸,若产生白色沉淀,说明含有氯离子.
(2)检验硫酸和可溶性的硫酸盐,即检验溶液中是否含有硫酸根离子,可用酸化的硝酸钡溶液,一般用硝酸钡溶液和稀硝酸,若产生白色沉淀,说明含有硫酸根离子.
(3)碳酸盐中含有碳酸根离子,碳酸根离子的检验方法是:将该碳酸盐少许于试管中,加入少量稀盐酸,观察到有气泡产生;将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,说明该化合物中含有碳酸根离子,说明该化合物是碳酸盐.
(4)铵盐与碱性物质混合研磨后能放出有刺激性气味的气体氨气,氨气能使湿润的红色石蕊试纸变蓝色;将铵盐和氢氧化钙混合后放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色.
故答案为:(1)硝酸银溶液和稀硝酸;(2)硝酸钡溶液和稀硝酸;(3)稀盐酸和澄清的石灰水;(4)熟石灰和湿润的红色石蕊试纸.
点评 本题难度不大,掌握氯离子、硫酸根离子、铵盐和碳酸盐的检验方法是正确解答本题的关键.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
12.生活离不开化学,下列选项中合理的是( )
| A. | 食用甲醛浸泡过的海产品,可提高人体免疫力 | |
| B. | 服用含有氢氧化铝的药物,治疗胃酸过多症 | |
| C. | 为了节约粮食,把霉变大米淘洗后食用 | |
| D. | 青少年适量补铁,可以预防佝偻病 |
13.下列说法错误的是( )
| A. | 在人类食物所供给的总能量中,有60%-70%来自于油脂 | |
| B. | 白糖、冰糖、红糖的主要成分就是蔗糖 | |
| C. | 很多食品发生霉变后,滋生的黄曲霉菌有很强的毒性 | |
| D. | 糖类是人类食物的主要成分,是由C、H、O三种元素组成的化合物 |
10.下列校园运动设施或器材中,没有用到合成材料的是( )
| A. | 钢质单杠 | B. | 塑胶跑道 | C. | 有机玻璃标示牌 | D. | 尼龙跳绳 |
17.小明向氢氧化钠溶液中滴加了稀盐酸,发现没有明显现象.为了判断两者是否恰好完全反应,他取少量反应后的溶液加入试管中,滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色.
(1)根据上述现象,小明得出“两种物质恰好完全反应”的结论.小白认为小明的结论是不合理的,其理由是无色酚酞遇到酸也是不变色.
(2)小白利用pH试纸测反应后溶液的pH,以确定两者是否恰好完全反应.请你选用其它试剂再设计一个实验,以验证氢氧化钠和盐酸是否恰好完全反应(要求写出选用的试剂、可能观察到的现象和相应的结论)Na2CO3,如果出现气泡那么盐酸有多出溶液显酸性,如果没有出现气泡则溶液显中性.
(3)小白为了继续探究“在氢氧化钠与盐酸反应的过程中,溶液的pH是如何变化的”这一问题,进行如下实验:在一定量的氢氧化钠溶液中逐渐滴加盐酸,用pH试纸测定溶液的pH,记录数据如下表:
图中能合理表示该反应过程中pH变化的图象是C.当盐酸加至10mL时,此时溶液中的阴离子有Cl-和OH-

(4)在此类测定中,为了确切知道该中和反应刚好完全,应在待测溶液中先滴入几滴酚酞试液,当看到溶液由红色刚好变为无色时,则证明中和反应正好完成.
(5)若取用的氢氧化钠溶液为40mL.稀盐酸的溶质质量分数为7.3%(两溶液的密度均以1.0g/mL计),根据图中数据,试计算:
①氢氧化钠溶液的溶质质量分数
②恰好完全反应时所得溶液中溶质的质量分数.
(1)根据上述现象,小明得出“两种物质恰好完全反应”的结论.小白认为小明的结论是不合理的,其理由是无色酚酞遇到酸也是不变色.
(2)小白利用pH试纸测反应后溶液的pH,以确定两者是否恰好完全反应.请你选用其它试剂再设计一个实验,以验证氢氧化钠和盐酸是否恰好完全反应(要求写出选用的试剂、可能观察到的现象和相应的结论)Na2CO3,如果出现气泡那么盐酸有多出溶液显酸性,如果没有出现气泡则溶液显中性.
(3)小白为了继续探究“在氢氧化钠与盐酸反应的过程中,溶液的pH是如何变化的”这一问题,进行如下实验:在一定量的氢氧化钠溶液中逐渐滴加盐酸,用pH试纸测定溶液的pH,记录数据如下表:
| 盐酸的体积/毫升 | 10 | 19.5 | 20 | 20.5 | 30 | 40 |
| pH | 12 | 11 | 7 | 3 | 2 | 1 |

(4)在此类测定中,为了确切知道该中和反应刚好完全,应在待测溶液中先滴入几滴酚酞试液,当看到溶液由红色刚好变为无色时,则证明中和反应正好完成.
(5)若取用的氢氧化钠溶液为40mL.稀盐酸的溶质质量分数为7.3%(两溶液的密度均以1.0g/mL计),根据图中数据,试计算:
①氢氧化钠溶液的溶质质量分数
②恰好完全反应时所得溶液中溶质的质量分数.
7.若将100克20%的某溶液的浓度降低到5%,需加水( )
| A. | 150克 | B. | 200克 | C. | 300克 | D. | 400克 |
6.某化学兴趣小组同学在回收废旧电池的同时,开展了如下的实验探究.
【查阅资料】废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.
【实验1】废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用.
(2)将铜帽放入盐酸中,除去锈污,冲洗备用.
【实验2】检验废干电池筒内黑色固体中MnO2的存在
兴趣小组同学设计了如图所示的实验:
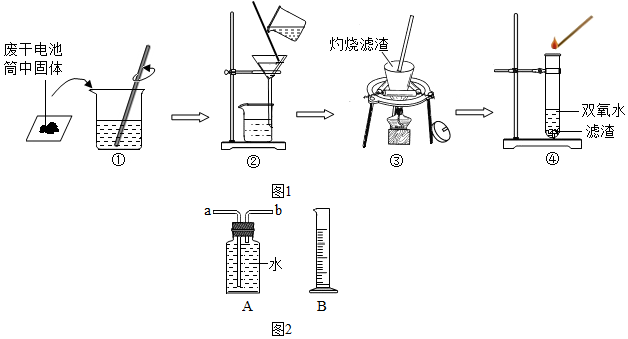
(1)操作②中过玻璃棒的作用是引流.
(2)引流操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,该反应的化学表达式为CO2.
(3)操作④试管中产生的气体能使带火星木条复燃,该气体为O2
(4)由此得出结论:滤渣中黑色固体化学式为MnO2和C
【实验3】利用回收锌皮制取氢气及相关探究
(1)用锌皮和稀硫酸制取氢气.用适当的发生装置,采用排水法收集并测定氢气的体积(如图2),气体从装置A导管口b(填“a”或“b”) 进,选用仪器B测量排出水的体积,仪器B名称是量筒.
(2)探究影响锌与稀硫酸反应快慢的因素.反应过程中用前10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表4组实验,获得数据如下.
[数据分析]
①比较实验a和实验b得到的结论是:与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率大.
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填实验编号).
③探究影响该反应快慢的因素,还需控制的条件是:温度(或锌粒形状大小)(举一例即可).
【实验4】探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较产生氧气速率的大小.
【查阅资料】废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.
【实验1】废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用.
(2)将铜帽放入盐酸中,除去锈污,冲洗备用.
【实验2】检验废干电池筒内黑色固体中MnO2的存在
兴趣小组同学设计了如图所示的实验:

(1)操作②中过玻璃棒的作用是引流.
(2)引流操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,该反应的化学表达式为CO2.
(3)操作④试管中产生的气体能使带火星木条复燃,该气体为O2
(4)由此得出结论:滤渣中黑色固体化学式为MnO2和C
【实验3】利用回收锌皮制取氢气及相关探究
(1)用锌皮和稀硫酸制取氢气.用适当的发生装置,采用排水法收集并测定氢气的体积(如图2),气体从装置A导管口b(填“a”或“b”) 进,选用仪器B测量排出水的体积,仪器B名称是量筒.
(2)探究影响锌与稀硫酸反应快慢的因素.反应过程中用前10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表4组实验,获得数据如下.
| 实验编号 | 试剂 | 前10 min内产生的 氢气体积(mL) | |
| 锌的纯度 | 稀硫酸的体积和浓度 | ||
| a | 纯锌 | 30 mL 30% | 564.3 |
| b | 含杂质的锌 | 30 mL 30% | 634.7 |
| c | 纯锌 | 30 mL 20% | 449.3 |
| d | 纯锌 | 40 mL 30% | 602.8 |
①比较实验a和实验b得到的结论是:与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率大.
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填实验编号).
③探究影响该反应快慢的因素,还需控制的条件是:温度(或锌粒形状大小)(举一例即可).
【实验4】探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较产生氧气速率的大小.