题目内容
17.小明向氢氧化钠溶液中滴加了稀盐酸,发现没有明显现象.为了判断两者是否恰好完全反应,他取少量反应后的溶液加入试管中,滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色.(1)根据上述现象,小明得出“两种物质恰好完全反应”的结论.小白认为小明的结论是不合理的,其理由是无色酚酞遇到酸也是不变色.
(2)小白利用pH试纸测反应后溶液的pH,以确定两者是否恰好完全反应.请你选用其它试剂再设计一个实验,以验证氢氧化钠和盐酸是否恰好完全反应(要求写出选用的试剂、可能观察到的现象和相应的结论)Na2CO3,如果出现气泡那么盐酸有多出溶液显酸性,如果没有出现气泡则溶液显中性.
(3)小白为了继续探究“在氢氧化钠与盐酸反应的过程中,溶液的pH是如何变化的”这一问题,进行如下实验:在一定量的氢氧化钠溶液中逐渐滴加盐酸,用pH试纸测定溶液的pH,记录数据如下表:
| 盐酸的体积/毫升 | 10 | 19.5 | 20 | 20.5 | 30 | 40 |
| pH | 12 | 11 | 7 | 3 | 2 | 1 |

(4)在此类测定中,为了确切知道该中和反应刚好完全,应在待测溶液中先滴入几滴酚酞试液,当看到溶液由红色刚好变为无色时,则证明中和反应正好完成.
(5)若取用的氢氧化钠溶液为40mL.稀盐酸的溶质质量分数为7.3%(两溶液的密度均以1.0g/mL计),根据图中数据,试计算:
①氢氧化钠溶液的溶质质量分数
②恰好完全反应时所得溶液中溶质的质量分数.
分析 (1)盐酸也不会使酚酞变红,所以可以据此解答该题;
(2)要验证盐酸和氢氧化钠是否完全反应可以考虑它们的性质来进行验证.
(3)根据氢氧化钠与盐酸的pH来分析判断.
(4)酚酞遇碱性溶液变红,遇中性溶液不变色.
(5)写出盐酸和氢氧化钠反应的化学方程式,根据已知的盐酸的质量,求氢氧化钠的质量和得反应后生成的氯化钠的质量,进而求氢氧化钠溶液的溶质质量分数和恰好完全反应时所得溶液中溶质的质量分数.
解答 解:(1)向氢氧化钠溶液中滴加稀盐酸,它们恰好完全反应时,溶液呈中性,但是不能仅仅通过酚酞不变色来判断这两种物质是恰好完全反应的,因为盐酸也不能使酚酞变色,所以如果滴加的稀盐酸是过量的,此时向反应后的溶液中滴加酚酞试液,溶液也不会变色;
(2)反应后的溶液加入试管中,滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色,说明氢氧化钠可能是恰好完全反应,也可能是盐酸剩余,因此可加入碳酸钠,若盐酸剩余会产生气泡,若不剩余则不产生气泡,就是恰好完全反应.
(3)氢氧化钠溶液pH大于7,加入盐酸pH不断变小,当恰好完全反应时为7,当酸过量时小于7,最终无限接近于0,但并不能为0,由表格中数据可以看出,开始加入盐酸,pH变化较小,当接近7时,加入少量盐酸,pH就有较大变化,故D错误;故选C.当盐酸加至10mL时,溶液的pH=12,氢氧化钠过量,此时溶液中的阴离子有Cl-和OH-.
(4)恰好完全反应时,溶液呈中性,酚酞呈无色.
(5)与氢氧化钠反应的盐酸的质量为:20mL×1.0g/mL×7.3%=1.46g
设消耗氢氧化钠的质量为x,生成氯化钠的质量为y
HCl+NaOH═NaCl+H2O
36.5 40 58.5
1.46g x y
$\frac{36.5}{1.46g}=\frac{40}{x}=\frac{58.5}{y}$
解得:x=1.6g,y=2.34g
氢氧化钠溶液的质量为40mL×1.0g/mL=40g
氢氧化钠溶液的溶质质量分数$\frac{1.6g}{40g}$×100%=4%
恰好完全反应时所得溶液中溶质的质量分数$\frac{2.34g}{40g+20mL×1.0g/mL}$×100%=3.9%
故答案为:(1)无色酚酞遇到酸也是不变色.(2)Na2CO3,如果出现气泡那么盐酸有多出溶液显酸性,如果没有出现气泡则溶液显中性. (3)C;Cl-和OH-.(4)溶液由红色刚好变为无色.(5)4%;3.9%
点评 中和反应的实质是氢离子和氢氧根离子结合成水的过程.酚酞试液不能指示溶液的酸性或中性.

| A. | 溶质的质量 | B. | 溶液的质量 | C. | 氯化钠的溶解度 | D. | 溶质的质量分数 |
| 豆腐干的主要成分 | |
| 蛋白质 | 4.70g |
| 油脂 | 1.30g |
| 糖类 | 2.80g |
| 维生素B1 | 0.06mg |
| 维生素B2 | 0.03mg |
| 钙 | 0.24g |
| 铁 | 1.40g |
①分子 ②原子 ③元素
(2)当人体缺钙时,可能引起的疾病是(填序号);①
①骨质疏松症 ②贫血症 ③夜盲症
(3)豆腐干中除了含有蛋白质、油脂、糖类、无机盐之外,还含有的营养素是维生素;
(4)豆腐干常用聚乙烯塑料袋包装,请指出使用聚乙烯塑料袋包装的利与弊(各答一条).利:使用方便;弊:造成白色污染.
| A. | 过磷酸钙〔Ca(H2PO4)2和CaSO4的混合物〕属于复合肥 | |
| B. | 凡施用过化肥的蔬菜都会危害健康 | |
| C. | 硫酸铵与熟石灰混合、研磨,能闻到刺激性的气味 | |
| D. | 可以通过观察,鉴别氮肥和钾肥 |
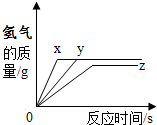 室温下,向三份等质量溶质质量分数相同的稀酸中分别加入镁、铁、锌三种金属粉末,反应生成的氢气质量与反应间的关系如图所示.根据图中的信息,下列判断不正确的是( )
室温下,向三份等质量溶质质量分数相同的稀酸中分别加入镁、铁、锌三种金属粉末,反应生成的氢气质量与反应间的关系如图所示.根据图中的信息,下列判断不正确的是( )| A. | 图线X表示镁的反反应情况 | |
| B. | 消耗y的质量最大 | |
| C. | 与x、y反应的盐酸一定被完全消耗 | |
| D. | 与z反应的盐酸一定过量,与x、y反应的盐酸可能过量 |
| A. | 一氧化碳与二氧化碳都是由碳元素组成的,所以它们的化学性质相同 | |
| B. | 金刚石和石墨里碳原子的排列不同,因此,它们的物理性质有很大的差别 | |
| C. | 二氧化碳通入石蕊试液中变红,是二氧化碳使石蕊试液变红 | |
| D. | 二氧化碳不支持燃烧,所有的物质着火燃烧都能用二氧化碳来灭火 |
