题目内容
8.某校化学兴趣小组同学为了测定某铁合金的含铁量,做了如下实验:称取11.4g样品放入质量为50.0g的烧杯中,再往烧杯内加入足量的100.0g稀盐酸(杂质不与酸反应),并对烧杯进行了四次称量,记录的数据如下:| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯总质量/g | 161.4 | 161.2 | 161.0 | 161.0 |
(1)反应产生的氢气的质量;
(2)该铁合金中铁的质量分数(精确到0.1%)
分析 由表中数据可知,当进行到t2时,合金中的铁和稀盐酸完全反应,根据质量差可以计算生成氢气的质量;
根据生成氢气的质量可以计算铁的质量,进一步可以计算合金中铁的质量分数.
解答 解:(1)生成H2质量=(11.4g+100.0g+50.0g)-161.0g=0.4g
(2)设11.4g铁合金中含铁质量为x
Fe+2HCl=FeCl2+H2↑
56 2
X 0.4g
$\frac{56}{x}=\frac{2}{0.4g}$
解得,x=11.2g
铁合金中铁的质量分数=$\frac{11.2g}{11.4g}$×100%=98.2%
答:该铁合金中铁的质量分数为98.2%.
点评 解答本题的关键是能够根据表中数据判断反应进行的情况,再通过化学方程式进行计算便可得出正确的答案.

练习册系列答案
相关题目
18.学校食堂提供以下食物,从营养角度考虑,最合理的选择是( )
①猪肉②鱼③米饭④青菜⑤苹果.
①猪肉②鱼③米饭④青菜⑤苹果.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ①④⑤ |
3.人间四月芬芳菲,春天校园百花开,阵阵花香,沁人心脾.花香四溢的现象说明( )
| A. | 分子是由原子组成的 | B. | 分子是不断运动的 | ||
| C. | 分子之间有一定的间隔 | D. | 分子具有一定的质量 |
13. 如图是铀在元素周期表中的信息,下列有关说法正确的是( )
如图是铀在元素周期表中的信息,下列有关说法正确的是( )
 如图是铀在元素周期表中的信息,下列有关说法正确的是( )
如图是铀在元素周期表中的信息,下列有关说法正确的是( )| A. | 铀的原子序数是92 | B. | 铀属于非金属元素 | ||
| C. | 铀原子的中子数是92 | D. | 铀的相对原子质量为238.0g |
20.6月5日是世界环境如,我国今年的主题为“绿水青山,就是金山银山”,下列做法不符合这一主题的是( )
| A. |  开发氢燃料电池客车 | B. |  使用太阳能路灯 | ||
| C. |  尾气直接排放 | D. |  分类回收垃圾 |
6.下列各选项与如图所示曲线相符的是( )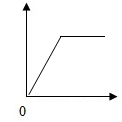

| 选项 | 横 坐 标 | 纵 坐 标 |
| A | 向一定量稀硫酸中加入锌粉的质量 | 溶液中氢元素的质量 |
| B | 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 | 溶液中溶质的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
7.下列图象能正确反映其对应关系的是( )

| A. | 向pH=9的溶液中不断加水 | |
| B. | 加热木炭和氧化铜的混合物 | |
| C. | 高温煅烧一定质量的石灰石 | |
| D. | 向FeCl3和HNO3的混合溶液中加入NaOH溶液直至过量 |